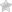Как известно, жиры образуются в животных и растительных организмах.
Жиры, или триглицериды, – это сложные эфиры, образованные глицерином и высшими жирными кислотами.
Свойства жиров во многом зависят от того, какие карбоновые кислоты входят в состав триглицерида. В образовании молекул триглицеридов могут участвовать как одинаковые, так и разные карбоновые кислоты. Чаще всего эти кислоты имеют неразветвлённое строение и содержат чётное число атомов углерода.
Строение жиров было установлено в начале 19 века. А сам жир впервые синтезировал М. Бертло.

В жирах наиболее часто встречаются такие высшие насыщенные карбоновые кислоты, как пальмитиновая, стеариновая, а также ненасыщенные: олеиновая, линолевая и линоленовая.
Природные жиры бывают твёрдыми и жидкими. Жидкие жиры ещё называют маслами. В твёрдых жирах, как правило, преобладают остатки насыщенных карбоновых кислот, а в жидких – остатки ненасыщенных карбоновых кислот.
Животные жиры в основном твёрдые, за исключением рыбьего жира, а растительные жиры, в основном жидкие, за исключением кокосового масла.
Плотность жиров меньше плотности воды, жиры в воде не растворимы. Жиры растворяются в органических растворителях, таких, как бензин, бензол, дихлорэтан, этанол. Это свойство используется для очистки одежды от жирных пятен.
Температура плавления жиров зависит от того, остатки каких карбоновых кислот здесь присутствуют.
Твёрдые жиры содержатся в жировых тканях наземных млекопитающих и птиц, а жидкие – в тканях морских млекопитающих и рыб, в костях копытных животных, в семенах и плодах растений.
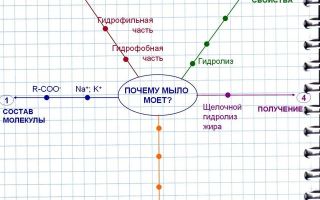
Для жиров характерны реакции гидролиза. В результате кислотного гидролиза образуется глицерин и смесь жирных кислот. При щелочном гидролизе образуется глицерин и соли насыщенных жирных кислот, которые называются мылами. Так, при щелочном гидролизе тристеарата образуется глицерин и натриевая соль стеариновой кислоты, которая является мылом.
Для жиров характерны реакции окисления. Эти реакции характерны для тех триглицеридов, в составе которых содержатся остатки ненасыщенных карбоновых кислот. При этом жиры окисляются и полимеризуются. Это свойство используется для изготовления олифы и лаков. Олифу изготавливают из льняного или конопляного масла.
Жиры при длительном хранении под действием влаги, кислорода, света, тепла приобретают неприятный запах и вкус. Этот процесс называется прогорканием.
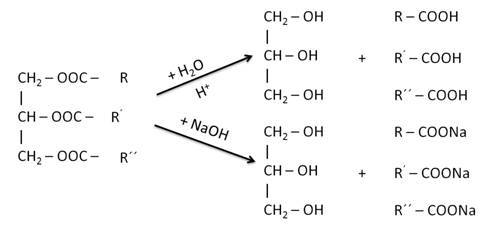
Для жидких жиров свойственны реакции гидрирования, так как в их составе есть остатки ненасыщенных карбоновых кислот. Так, при гидрировании триолеин глицерина образуется тристеарат глицерина.
Реакцией гидрирования из жидких жиров получают твёрдые. Впервые этот метод разработал русский химик С. А. Фокин.
Полученный таким образом твёрдый жир используется для получения мыла, глицерина, стеарина.
Такие жиры обесцвечивают раствор перманганата калия, бромную воду.
Жиры являются составной частью пищи человека и животных. В организме они расщепляются до глицерина и карбоновых кислот, из которых затем синтезируются жиры, специфические для данного организма.
- Жиры являются поставщиками необходимых карбоновых кислот, которые не синтезируются в организме человека.
- Кроме этого, жиры – это основной источник энергии для живых организмов, так как при их расщеплении выделяется в два раза больше энергии, чем при расщеплении углеводов.
- Жиры широко используют в пищевой и парфюмерной промышленности, в фармацевтической промышленности, их применяют в производстве глицерина, мыла, карбоновых кислот.
Мыла представляют собой растворимые в воде натриевые и калиевые соли высших жирных кислот, в основном пальмитиновой, стеариновой и олеиновой кислот. Мыла обладают моющими свойствами, то есть способны удалять с отмываемой поверхности прилипшие частицы грязи, жира и переводить их во взвешенное состояние в виде эмульсий и суспензий.
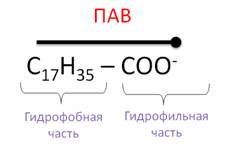
Как происходит этот процесс? Натриевые и калиевые соли представляют собой молекулы, в составе которых присутствуют фрагменты с противоположными свойствами по отношению к воде: гидрофобный фрагмент, который не растворим в воде, а растворим в жирах, и гидрофильный фрагмент, который растворим в воде.
Такие молекулы характерны для поверхностно-активных веществ (ПАВ), они понижают поверхностное натяжение на границе раздела двух жидкостей или жидкости и газа.
То есть, очищающий эффект мыла осуществляется следующим образом: гидрофобные, или неполярные, концы молекул стеаратов калия и натрия растворяются в каплях жира, а полярные карбоксилат-ионы остаются в водном растворе. В результате чего капли жира отталкиваются от ткани и переходят в воду, при этом образуется устойчивая эмульсия жира в воде.
Мыла являются хорошими пенообразователями. Так, к пузырькам пены прилипают загрязнённые частицы, и они легко удаляются.
Но моющие свойства мыла в жёсткой воде утрачиваются, так как жёсткая вода содержит соли кальция и магния, а при их взаимодействии со стеаратами калия и натрия образуются нерастворимые в воде кальциевые и магниевые соли высших карбоновых кислот. Поэтому при стирке в жёсткой воде образуется не пена, а хлопья осадка.
![]()
Мыло используется в текстильной промышленности для промывки тканей, шерсти, при крашении тканей, в производстве искусственного каучука и смол.
Мыла используют как смазочно-охлаждающие жидкости, металлические мыла, содержащие Ca и Al, применяют для производства водонепроницаемых тканей и бумаги; мыла, содержащие Pb, Co, Mn применяются в производстве олиф, лаков и красок.
Мыла, содержащие соли Cu, Hg, применяют для защиты обшивки судов от улиток и ракушек. Моющим действием обладают не только мыла, но и СМС – синтетические моющие средства. К СМС относятся алкан— и алкиларенсульфонаты.
Если это натриевая соль, то мыло будет твёрдым, если это калиевая соль – то это жидкое мыло. Они также обладают поверхностно-активными свойствами, потому что здесь есть и гидрофобная группа, и гидрофильная группа.
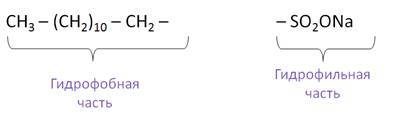
Однако СМС имеют и ряд преимуществ: процесс пенообразования и моющее действие у них выше, чем у мыла, они сохраняют свои моющие свойства даже в жёсткой воде, так как их кальциевые и магниевые соли являются растворимыми. Если раствор мыла имеет щелочную среду, но раствор СМС имеет нейтральную среду.
Обычно стиральные порошки содержат около 70 % синтетических моющих средств и 30 % неорганических фосфатов, которые при стирке удаляют растворимые соли кальция.
Таким образом, жиры представляют собой смесь триглицеридов, образованных глицерином и высшими карбоновыми кислотами. Свойства жиров зависят от состава триглицеридов. Важным свойством жиров является гидролиз.
Жиры являются ценным пищевым энергетическим продуктом и имеют широкое применение. К моющим средствам относят мыла и синтетические моющие средства. Моющие средства являются поверхностно-активными веществами и содержат полярную (гидрофильную) и неполярную (гидрофобную) группы.
Синтетические моющие средства в отличие от мыла сохраняют моющие свойства в жёсткой воде.
Источник: https://videouroki.net/video/30-zhiry-i-myla.html
Конспект урока-исследования по теме «Мыло» (10 класс)
- Конспект урока-исследования по теме «Мыло»
- (10 класс)
- Лукашина Ирина Вячеславовна, преподаватель
- МОУ СОШ №7 г. Мичуринска Тамбовской области
- I часть (ВВОДНАЯ БЕСЕДА)
Добрый день, уважаемые коллеги! Да, да, именно коллеги.
Ведь вы, так же как и я, пришли сюда постигать основы химии.
Сегодня мы займемся поиском истины, поработаем в творческой лаборатории. На ваших столах находятся «путеводители», в которых вы будете делать записи. Они останутся у вас после урока и будут служить вам основой для выполнения домашнего задания.
Ну а чтобы подготовиться к сегодняшнему исследованию, выполним тренировочное задание № 1. Оно поможет вам вспомнить формулы некоторых органических соединений, которые пригодятся нам на уроке.
В левом столбике таблицы предложены названия органических соединений, а в правом – их соответствующие недописанные формулы («полуфабрикаты»). Ваша задача – дописать недостающие функциональные группы в формулы веществ.
(Время выполнения задания 2 мин.)
| № п/п | Недописанная формула вещества | Название органического соединения |
| 1 |
|
Глицерин (пропантриол) |
| 2 | CH3 – (CH2)15 –СН2- __________ | Стеарат натрия |
| 3 |
|
Изопропиловый спирт |
| 4 | CH3 – _______ – CH3 | Метиловый эфир уксусной кислоты |
| 5 | CH3 – (CH2)7 – CH = CH – (CH2)7 — _______ | Олеиновая кислота |
- Проверим ответы (работа с интерактивной доской на слайде 2).
- II часть (ПОСТАНОВКА ЦЕЛИ И ЗАДАЧ)
- Итак, мы в творческой лаборатории.
Любое исследование строится по определенной траектории (Рис.1).
Как видно из схемы, в основе исследования лежит проблема, на основе которой формулируется цель и задачи работы.
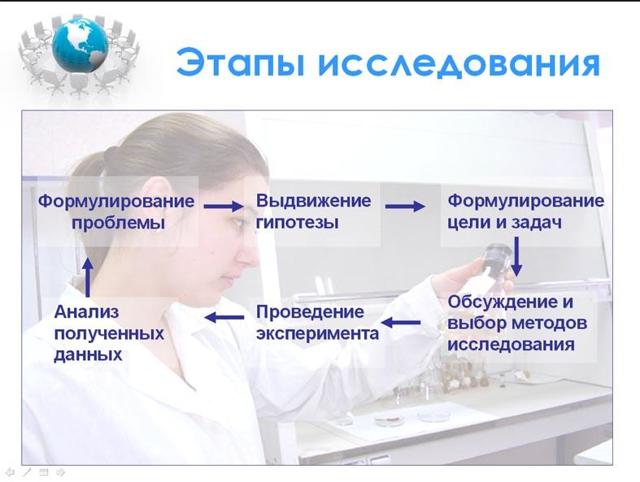
Рис. 1. Слайд 3
- Для того, чтобы определить проблему, которую нам сегодня предстоит решить, предлагаю посмотреть фрагмент известного мультипликационного фильма.
- Просмотр фрагмента мультфильма «Мойдодыр»
- Какую проблему затрагивает данный мультфильм?
- Проблему грязных рук, отмывания грязи.
- И какое средство решения данной проблемы предлагают авторы?
- Мыло.
Это вещество и будет служить объектом сегодняшнего исследования. Тема нашего занятия «Мыла». Впишите ее в титульный лист своего путеводителя.
Итак, авторы предлагают решить проблему грязных рук средствами мыла. Какой проблемный вопрос здесь возникает?
Почему мыло моет?
По мере продвижения нашей работы мы будем заполнять логико-смысловую модель, которая заменит вам краткий конспект (рис. 2).
- Внесем в ее центр проблемный вопрос, который нам предстоит решить «Почему мыло моет?» (работа с интерактивной доской)
- Предлагаю сформулировать цель нашего исследования.
- (Цель и задачи формулируют школьники)
- Цель: Рассмотреть особенности строения и свойств мыла, определяющие его моющую способность.
- А теперь сформулируем задачи, которые служат этапами нашей работы.
- 1) Рассмотреть состав
- 2) Строение молекулы мыла.
- 3) Изучить его свойства.
- 4) Способы получения мыла.
- 5) Воздействие мыла на организм человека.
- Заполнение названий стрелок в ЛСМ согласно сформулированным задачам.
- Работа с интерактивной доской.
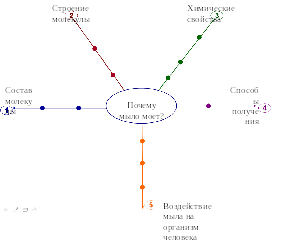
Рис. 2 Логико-смысловая модель по теме «Мыла»
III часть (РЕШЕНИЕ ПРОБЛЕМЫ)
Для решения проблемного вопроса, который мы с вами поставили, нам придется решить несколько проблемных задач. Вот одна из них: Почему при попадании мыла в глаза мы испытываем неприятное ощущение?
- Вероятно, влияет среда раствора (кислая или щелочная).
- Ответить на этот вопрос нам поможет химическое свойство мыла – гидролиз.
- Вспомнить: Гидролиз – это взаимодействие веществ с водой.
- Определить среду раствора мыла вы сможете, проведя опыт № 1, воспользовавшись рекомендациями.
Рекомендации: В пробирку с раствором мыла (химический стаканчик) поместите индикаторную бумагу. Проанализируйте среду раствора в соответствии с окраской бумаги.
Эталонная шкала для рН
кислая среда щелочная
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 |
Вопрос для размышления: Какое вещество образуется при гидролизе мыла?
Работа проводится в парах. Время работы 1 минута.
- Обратите внимание, что для достоверности результатов исследования мы предложили вам образцы разных видов мыла.
- Не забывайте о правилах техники безопасности при проведении эксперимента!
- Время выполнения задания 1 мин.
Индикаторная бумага посинела, следовательно, среда щелочная. Значит, при гидролизе мыла образуется щелочь.
- Какие катионы металлов образуют щелочь?
- Ионы натрия, лития, калия (щелочных металлов).
- А как определить их наличие в растворе? (по окрашиванию цвета пламени)
- Демонстрационный опыт:
Мы вносим медную проволоку, смоченную раствором жидкого мыла, в пламя спиртовки. В какой цвет оно окрашивается?
- Фиолетовый.
- О наличии каких катионов это свидетельствует?
- Катионов калия (K+).
Мы вносим раствор твердого мыла в пламя спиртовки. В какой цвет оно окрашивается?
- Желтый.
- О присутствии каких катионов это свидетельствует?
- Катионов натрия (Na+).
Вывод: в состав твердого мыла входят ионы натрия, в состав жидкого – ионы калия. (Заполните, пожалуйста, соответствующую стрелку ЛСМ).
Для того, чтобы рассмотреть вторую составную часть молекулы мыла, ознакомимся со способом его получения (рис. 3).

Рис. 3. Слайд 7
В основе получения мыла лежит реакция щелочного гидролиза жиров (сложных эфиров глицерина и высших карбоновых кислот).
В специальных ёмкостях (варочных котлах) нагретые жиры омыляют щёлочью (обычно гидроксидом натрия). В результате реакции образуется однородная вязкая жидкость, густеющая при охлаждении — мыльный клей.
Основываясь на формулах исходных веществ, составьте формулы продуктов реакции. Не забывайте, что ключевое слово в данном процессе – гидролиз. Механизм обменный. Молекула исходного вещества должна распасться на составные части, которые дополнятся соответствующими частицами. Каковы продукты данной реакции?
- Глицерин и соль карбоновой кислоты
- (Один ученик у доски) Работа с интерактивной доской.
- H2C – OCO – R H2C – OH
- ׀ ׀
- HC – OCO – R 3NaOH HC – OH 3R – COONa
- ׀ ׀
- H2C – OCO – R H2C – OH
- животный жир каустическа сода глицерин соль карб. кислоты
- Предлагаю сформулировать вывод о составе мыла.
Вывод: Мыла – это соли высших карбоновых кислот. (Запишите определение и заполните ЛСМ).
- Чаще всего для получения мыла используют тристеарат глицерина.
- В рабочей тетради допишите уравнение соответствующей реакции – задание № 2.
- Допишите уравнение реакции щелочного гидролиза тристеарата глицерина.
- H2C – OCO – C17H35
- ׀
- HC – OCO – C17H35 + 3NaOH
- ׀
- H2C – OCO – C17H35
- Работа индивидуальная.
- Время выполнения задания 1 мин.
- Проверим результаты (на доске).
- РЕЛАКС
Без какого вещества, на ваш взгляд, трудно представить хозяйственную деятельность мыла? Без воды. Вот и вам предлагаю немного расслабиться, закрыть глаза и представить капельки воды, звенящие, переливающиеся на солнышке. (Музыкальный фрагмент).
Время релаксации 30 сек.
Итак, мы приближаемся к решению поставленного нами в начале урока проблемного вопроса «почему мыло моет?».
Химия – удивительная наука. Она позволяет судить о невидимых процессах и веществах благодаря моделированию.
Рассмотрим модель молекулы мыла (Рис. 4).
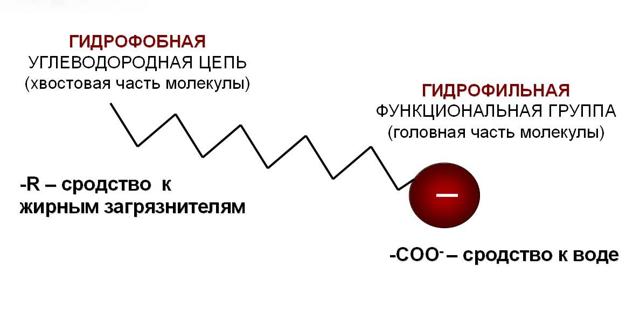
Рис. 4. Модель молекулы мыла
- Молекула мыла состоит из двух частей: большого углеводородного радикала, обладающего водоотталкивающими свойствами (гидрофобными), и полярной карбоксильной группы, растворимой в воде (гидрофильная часть). (Заполнение ЛСМ, стрелка № 2)
- Вода, с которой приходится соприкасаться мылу, обладает целым рядом удивительных свойств (способностей), одним из которых является поверхностное натяжение.
- Проблемный вопрос: Как вы думаете, как поверхностное натяжение влияет на моющую способность воды?
- Благодаря поверхностному натяжению вода сама по себе является чрезвычайно плохим смачивателем, и поэтому не может обеспечить эффективный моющий процесс.
- В чем заключается «работа» мыла?
- Оно уменьшает поверхностное натяжение.
- В качестве доказательства этой гипотезы предлагаю посмотреть видео-опыт.
Видео-опыт: в чашку Петри на поверхность воды поместили небольшое количество детской присыпки. Добавили несколько капель раствора мыла. Частички присыпки «разбегаются» в разные стороны.
- Чтобы рассмотреть процесс отмывания грязи, что называется, изнутри, ознакомимся с анимационной моделью.
- Работа с анимационной моделью.
- Молекулы мыла гидрофобными концами присоединяются к частичке грязи, гидрофильными концами – к молекулам воды.
За счет уменьшения поверхностного натяжения воды происходит отрыв грязевой частички от субстрата и выталкивание ее в раствор. Поэтому стоит только немного приложить усилий (ручная стирка или машинная), и субстрат очистится от грязевых частиц.
Теорию моющего процесса создал наш соотечественник, Герой Социалистического Труда академик Петр Александрович Ребиндер.
Мы ответили на главный вопрос «почему мыло моет?».
А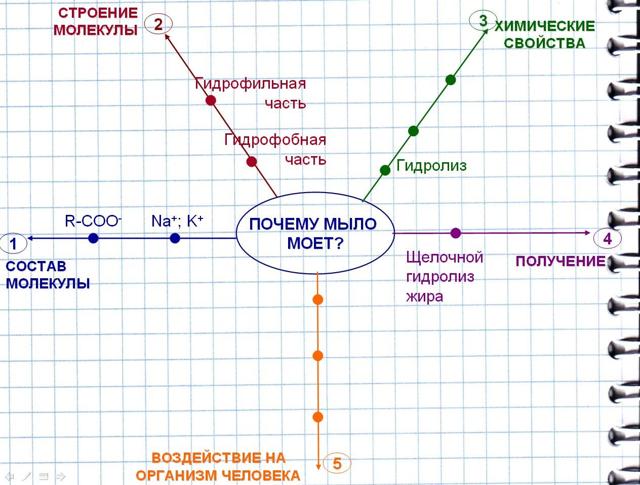 нализ ЛСМ (Рис. 5)
нализ ЛСМ (Рис. 5)
Рис. 5. Логико-смысловая модель по теме «Мыла» (заполненная)
А какое воздействие на человеческий организм оказывает мыло?
Положительный эффект обусловлен моющей способностью (смывает грязь, лишний жир, пот и др. вещества с поверхности кожи, волос), тем самым защищая нас от воздействия бактерий, для которых это благодатная среда для размножения.
Но… Есть и отрицательное воздействие.
Во-первых, при гидролизе мыла образуется щелочь, вредно действующая на кожу. Во-вторых, многие добавки, содержащиеся в мылах, могут вызывать аллергическую реакцию на коже за счет различных добавок.
- Качество того мыла, которое имеется у вас дома, вы сможете определить, проанализировав состав и сравнив его с имеющимися данными о вредном влиянии некоторых компонентов в таблице № 1.
- Таблица 1
- Роль некоторых добавок в моющих средствах
| Название | Роль в моющем средстве | Воздействие на организм человека |
| Лаурилсульфаты | Играет моющую и пенообразующую роль | Аллергические реакции, раздражающее воздействие на кожу. С приемом пищи попадают в организм, оказывая отрицательное токсическое воздействие. |
| Тетранатриевая соль (Трилон Б) | Компонент, смягчающий жесткую воду | Раздражающее действие на слизистые оболочки глаз. Общетоксическое (на почки)действие. |
| Диэтаноламид ДЭА Триэтаноламин | Стабилизатор пены; загуститель | Раздражающее действие на неповрежденные кожные покровы и слизистую оболочку глаз. Опасен при проглатывании (тошнота, кашель). |
| Фосфаты натрия и калия | Комплексообразователи и моющие агенты | Снижают у кожи барьерную функцию. Биогенные вещества. |
Проблемный вопрос: Как сделать мыло не только моющим, но и полезным для кожи?
Необходимо помимо жирных кислот включать в состав мыла лечебные экстракты. Например, душистое полезноемыло со свежим мёдом, с маслом оливы и цветками календулы. Действие: максимально увлажняет кожу, делает её гладкой и бархатистой, запах мёда действует успокаивающе на нервную систему.
- В домашних условиях можно сварить хорошее мыло на основе детского или хозяйственного.
- В рабочей тетради вам предлагается рецепт «апельсинового» мыла.
- Рецепт «полезного» мыла
Возьмем сок 3-х апельсинов. Цедру нарежем мелко на квадратики. Мыло (детское или хозяйственное) натрем на терке.
На водяную баню размещаем емкость, в которую заливаем 150 мл воды, добавляем 3-4 столовые ложки оливкового масла, мыло и цедру.
Аккуратно перемешиваем, вливаем в емкость тонкой струйкой сок апельсинов и добавляем 2-3- столовые ложки овсяных хлопьев. Перемешиваем, держим на бане 2-3-мин и снимаем с огня.
В полученную массу добавляем 4 капли эфирного масла (на выбор) и разливаем по заготовленным формочкам.
- Мыло должно вызреть в течение 2 недель.
- Вы можете менять его состав в зависимости от вашей фантазии.
- IV часть (ИТОГИ. РЕФЛЕКСИЯ)
Подведем итог нашей работы. Проверьте и дополните, если это необходимо, стрелочки логико-смысловой модели (ЛСМ) Мы ставили перед собой проблемный вопрос «Почему мыло моет?». Какие варианты ответов на него вы сейчас можете предложить?
Ответы:
- За счет гидролиза молекул с образованием щелочной среды.
- За счет уменьшения поверхностного натяжения воды молекулами мыла.
- За счет способности молекул мыла обволакивать частички грязи и перемещать их с поверхности субстрата.
И еще несколько проблемных вопросов.
- Почему во все лосьоны для очистки кожи лица, помимо веществ, растворяющих кожное сало и удаляющих загрязнения, обязательно добавляют слабые кислоты?
При гидролизе мыла образуется щелочной раствор, неблагоприятно влияющий на кожу. Для его нейтрализации используют слабые кислоты.
- Где расходуется больше мыла: в мягкой или жесткой воде?
Больше мыла расходуется в жесткой воде, т.к. при взаимодействии с ионами кальция образуются нерастворимые соли.
- Почему людям с повышенной жирностью кожи лица и головы врачи-дерматологи рекомендуют умываться и мыть голову жидким мылом или «зеленым мылом»?
Калиевые соли высших карбоновых кислот по сравнению с натриевыми лучше растворяются в воде и поэтому обладают более сильным моющим действием.
- Почему мыло плохо мылится в морской воде?
Морская вода в большом количестве содержит ионы магния и кальция, которые образуют нерастворимые соли карбоновых кислот.
Вопрос № 5 вам предлагается рассмотреть дома. Отвечая на него дома, дополните стрелочку «Химические свойства» ЛСМ.
Мы хорошо с вами потрудились. (Анализ работы)
Рефлексия: Английский писатель Марк Твен сказал: «Мыльный пузырь – самое изысканное чудо природы». Предлагаю немного почудить. Если у вас хорошее настроение, если вам понравилось наше исследование, пускайте мыльные пузыри.
8
Источник: https://kopilkaurokov.ru/himiya/uroki/konspekt_uroka_issledovaniia_po_teme_mylo_10_klass
«Мыло» сообщение по химии

Доклад на тему «Мыло» кратко расскажет Вам много полезной информации об этом химическом продукте, и узнаете интересные исторические факты про его изобретение.
Мыло является твердым или жидким продуктом, состоящим из поверхностных, активных веществ, соединенных с водой. Сегодня оно используется для отделки тканей, как моющее средство, в водоэмульсионных красках и полировках, для производства косметики, во взрывчатых веществах.
История мыловарения: кратко
Согласно одной версии мыловарение изобрели в Шумере. Но археологические раскопки в Ниле показали, что все же родиной мыла является Древний Египет. Здесь мыловарение было развито еще 6000 лет тому назад и об этом свидетельствуют записи на папирусе. В период античности пользовались такими сортами мыла – жидкое, мягкое и твердое.
С 164 года римляне применили его как моющее средство. В Средневековье мылом могли пользоваться только священники и дворяне. Мыловарение в Западной Европе распространилось в XII-XIII веках. Позже оно превратилось в промышленную отрасль, центром которого стал Марсель. С конца XIV века мыловарение активно развивалось в Греции, Испании, Италии и Германии.
Сегодня мыло производят не только на заводах, ценится и ручная работа.
Промышленное производство мыла
Мыловарение состоит из 2-ух стадий:
- Варка мыла (химическая стадия)
Из солей натрия (реже калия), жирных кислот или заменителей делают водный раствор. После обработки щелочью неочищенных жиров получается клеевое мыло.
Смесь очищают и обрабатывают электролитами – щелочью NaOH или раствором NaCl. Таким образом мыло расслаивается: верхний слой это концентрированное мыло, а нижний является подмыльным щелоком (вода и глицерин).
Мыло в таком случае называется ядровым или хозяйственным.
Данная стадия характеризуется механической обработкой: охлаждением, сушкой, смешиванием с добавками, отделкой и упаковкой. Специальной пилирной машиной мыло перетирают валиками и придают нужную форму, спрессовав его.
Чтобы получить туалетное мыло, в хозяйственном мыле искусственным путем снижают содержание воды до 12% и вместо нее добавляют парфюмерные отдушки, отбеливатели и красители.
Для получения мыльных паст в массу добавляют толченый кирпич, тонкоизмельченный песок, жирные глины.
Самые элитные и лучшие сорта мыла характеризуются наличием пальмового или кокосового масла. Иногда в него вводятся жидкое стекло и сапонин.
Надеемся, что сообщение на тему «Мыло» помогло Вам подготовиться к занятию, и Вы узнали много полезной информации об этом продукте. А рассказ о мыле Вы можете дополнить через форму комментариев.
Источник: https://kratkoe.com/myilo-soobshhenie-po-himii/
Мыло — сообщение по химии 10 класс
Любой уважающий себя человек не сможет предоставить свою жизнь без мыла. Оно символизирует чистоту и личную гигиену. С научной точки зрения мыло – твердое или жидкое вещество, которое содержит в себе соединения контактирующие с водой и вызывающие раздражение у грязных веществ. На кожу человека это отрицательного эффекта не несёт, но несёт эффект очистки.
У мыла существует две функции, по этим же функциям мыло разделяется на типы. В основном мыло используют, как косметическое средство для нанесения на поверхность кожи для такого применения выпускают туалетное мыло. Так же мыло может быть использовано в бытовых целях, для стирки, чистки и т.д. Для таких случаев выпускают хозяйственное мыло.
В любой вид мыла в состав входят соли жирных кислот, которые способны растворяться. Ещё их называют стеарат натрия. Многие считают, что другие косметичекие и моющие вещества схожи по составу с мылом, но это не так.
Исследования доказали, что мыло стали использовать с Древнейших времён. В Вавилоне 2200 году до н.э. люди мылись с помощью мыла. Структура его отличалась от современного кусочка мыла, но по своим свойствам и функциям он был схож. Древний Рим и Египет не отставал. Правители этих империй использовали в данных условиях твердое мыло.
Изобретение мыла началось с наблюдения за тем, как эффективно натуральные биологические масла способны счищать грязь с поверхности кожи. Прежде всего это было замечено во время поедания жирной пищи руками.
После промывания таких рук в воде пятен грязи не оставалось. Так человечество вдохновилось на создание мыла.
Притом такую возможность имели только южные страны, ведь на севере природных жиров нет, а животные не подходят для такого применения.
В 1808 году французский химик по просьбе текстильной фабрики установил точный состав мыла. Тогда и выяснилось, что не только жиры, но и растворимые соли составляют основу мыла.
В 1930х годах в Америке и Европе сформировалось активное производство мыльной продукции.
Строились целые башни, где с помощью паровой обработки в мыло добавляли ароматизаторы, которые придавали мылу ещё и приятный запах.
В настоящее время в каждом доме возле раковины лежит твердое или жидкое мыло. И не только в домах, но и в офисах, школах, государственных учреждениях в каждом туалете оборудовано место для мыла, ведь это неотъемлемая часть жизни человека. Которая помогает поддерживать чистоту и здоровье.
Вариант 2
В доме каждого человека или семьи можно найти разного рода химические соединения, помогающие именно в домашнем быту. Это, к примеру, поваренная соль, уксус или обыкновенная сода. К числу таких предметов относится и мыло. Каких видов оно бывает? Как его получили? И какие свойства оно имеет?
Главные элементы мыла – это соли жирных кислот и вода. Формулы, абсолютно точно отражающей строение мыла, нет. Но приблизительно можно сказать, что она следующая: C17H35COONa. Некоторые путают настоящее мыло с моющим средством или мыльными продуктами, хотя это 2 разные вещи. В мире мыло встречается только в двух видах: либо жидкое, либо твердое.
Однако, твердый вид мыла имеет свои вариации. Получать мыла начали еще во времена Вавилона, то есть, где – то около 2800 года до нашей эры. А вот узнать точный состав мыла, по сравнению с его получением, удалось очень нескоро. Случилось это в 1808 году, благодаря французу Мишелю Жеврелю. Для обоих видов мыла используют дозаторы.
Если говорить проще, они для более комфортного использования мыла.
Разновидности мыла.
Начать стоит с жидкого, так как оно не делится ни на какие типы. К какому агрегатному состоянию это мыло относится, понятно из названия. Если смотреть на химический состав жидкого мыла, то ближе всего он к шампуням.
В отличие от другого вида мыла, этот можно сделать и в домашних условиях. Используют такое мыло как средство для мытья рук. Второй вид мыла – твердый. Вот тут надо остановиться и подробнее рассмотреть каждый тип.
Хозяйственное мыло.
В состав входят следующие вещества: соли кислот (в среднем, 55%), щелочь (0,1%), карбонаты натрия или калия (1%) и нерастворимый остаток (1%). Используют при стирке.
Мыло, сделанное вручную.
Да, и такое возможно. Если говорить по – другому, то это можно назвать мылом домашнего производства. Кстати, достаточно дорогое удовольствие.
Продукты, которые добавляются в мыло, дозаторы и ароматизаторы – это все обойдется на большую сумму. Также в мыло добавляют масла, в основном эфирные. Цель их использования – мытье рук или всего тела.
Кстати, есть еще одно негативное применение мыла. Если кто не знает, перед тем как повеситься, веревку смазывают мылом.

Источник: https://sochinite.ru/otvety/himiya/mylo-soobshchenie-10-klass
Строение мыла (химия мыла)
Строение мыла, его свойства
Мыла – это натриевые или калиевые соли высших жирных кислот (схема 1), гидролизующихся в водном растворе с образованием кислоты и щелочи.
- Общая формула твердого мыла:
- Cоли, образованные сильными основаниями щелочных металлов и слабыми карбоновыми кислотами, подвергаются гидролизу:
Образовавшаяся щелочь эмульгирует, частично разлагает жиры и освобождает таким образом прилипшую к ткани грязь. Карбоновые кислоты с водой образуют пену, которая захватывает частицы грязи. Калиевые соли по сравнению с натриевыми лучше растворимы в воде и поэтому обладают более сильным моющим свойством.
Гидрофобная часть мыла проникает в гидрофобное загрязняющее вещество, в результате поверхность каждой частицы загрязнения оказывается окруженной оболочкой гидрофильных групп.
Они взаимодействуют с полярными молекулами воды. Благодаря этому ионы моющего средства вместе с загрязнением отрываются от поверхности ткани и переходят в водную среду.
Так происходит очистка загрязненной поверхности моющим веществом.
Производство мыла состоит из двух стадий: химической и механической. На первой стадии (варка мыла) получают водный раствор натриевых (реже калиевых) солей, жирных кислот или их заменителей.
Получение высших карбоновых кислот при крекинге и окислении нефтепродуктов:
Получение натриевых солей:
СnHmCOOH + NaOH = СnHmCOONa + H2O.
Варку мыла заканчивают обработкой мыльного раствора (мыльного клея) избытком щелочи или раствором хлорида натрия. В результате этого на поверхность раствора всплывает концентрированный слой мыла, называемый ядром. Полученное мыло называют ядровым, а процесс его выделения из раствора – отсолкой или высаливанием.
Механическая обработка заключается в охлаждении и сушке, шлифовке, отделке и упаковке готовой продукции.
В результате мыловаренного процесса мы получаем самую разнообразную продукцию, с которой вы можете ознакомиться.
Производство хозяйственного мыла заканчивают на стадии высаливания, при этом происходит очистка мыла от белковых, красящих и механических примесей.
Производство туалетного мыла проходит все стадии механической обработки. Наиболее важной из них является шлифовка, т.е.
переведение ядрового мыла в раствор кипячением с горячей водой и повторным высаливанием. При этом мыло получается особо чистым и светлым.
- Стиральные порошки могут:
- • раздражать дыхательные пути;
- • стимулировать проникновение в кожу ядовитых веществ;
- • вызывать аллергию и дерматит кожи.
- Во всех этих случаях необходимо перейти на использование мыла, единственным недостатком которого является то, что оно сушит кожу.
- Если мыло варилось из животных или растительных жиров, то из раствора после отделения ядра выделяют образующийся при омылении глицерин, который находит широкое применение: в производстве взрывчатых веществ и полимерных смол, как умягчитель ткани и кожи, при изготовлении парфюмерных, косметических и медицинских препаратов, в производстве кондитерских изделий.
В производстве мыла применяют нафтеновые кислоты, выделяемые при очистке нефтепродуктов (бензина, керосина). С этой целью нефтепродукты обрабатывают раствором гидроксида натрия и получают водный раствор натриевых солей нафтеновых кислот.
Этот раствор упаривают и обрабатывают поваренной солью, в результате чего на поверхность раствора всплывает мазеобразная масса темного цвета – мылонафт. Для очистки мылонафта его обрабатывают серной кислотой. Этот нерастворимый в воде продукт называют асидолом или асидол-мылонафтом.
Непосредственно из асидола изготовляют мыло.
Источник: https://www.treeland.ru/article/eko/soaphome/chemistrysoap.htm
Мыла
Мыла, соли высших жирных кислот. В производстве и быту мылом называют технические смеси водорастворимых солей этих кислот, часто с добавками некоторых других веществ, обладающие моющим действием.
Основу смесей обычно составляют натриевые (реже калиевые и аммониевые) соли насыщенных и ненасыщенных жирных кислот с числом атомов углерода в молекуле от 12 до 18 (стеариновой, пальмитиновой, миристиновой, лауриновой и олеиновой).
К мылам часто относят также соли нафтеновых и смоляных кислот, а иногда и другие соединения, обладающие в растворах моющей способностью. Не растворяющиеся в воде соли жирных кислот и щёлочноземельных, а также поливалентных металлов называются «металлическими» мылами.
Водорастворимые мыла типичные мицеллообразующие поверхностно-активные вещества. При концентрации выше определённого критического значения в мыльном растворе наряду с отдельными молекулами (ионами) растворённого вещества находятся мицеллы коллоидные частицы, образованные скоплением молекул в крупные ассоциаты.
Наличие мицелл и высокая поверхностная (адсорбционная) активность мыла обусловливают характерные свойства мыльных растворов: способность отмывать загрязнения, пениться, смачивать гидрофобные поверхности, эмульгировать масла и др.
Приготовление мыла обработкой жиров растительной золой, известью и естественными щелочами, по свидетельству Плиния Старшего, было известно ещё древним галлам и германцам. Упоминание о мыле встречается у римского врача Галена (2 в. н. э.). Однако как моющее средство мыло стали использовать значительно позже; к 17 в.
оно, по-видимому, было уже достаточно распространено в Европе. Мыловаренная промышленность возникла в 19 в., чему способствовали развитие химии жиров (работы французского химика М. Э. Шеврёля, 18131823) и создание достаточно широкого производства соды по способу французского химика Н. Леблана (1820).
Современная мыловаренная промышленность выпускает мыла различных типов и сортов. По назначению различают хозяйственные, туалетные и технические мыла; они бывают твёрдыми, мягкими, жидкими и порошкообразными.
Жировым сырьём в производстве мыла служат жиры животные и жирные масла растительные, а также жирозаменители синтетические жирные кислоты, канифоль, нафтеновые кислоты, талловое масло. Твёрдые сорта мыла получают из твёрдых жиров и саломасов отверждённых гидрогенизацией растительных масел или жидких жиров морских животных.
Сырьём для жидких мыл служат в основном жидкие растительные масла, наряду с которыми используют жирозаменители. В производстве туалетного мыла жидкого жирозаменители не применяют.
Технологический процесс получения мыла складывается из 2 этапов: варки мыла и переработки сваренного мыла в товарный продукт. Варку мыла проводят в специальных аппаратах варочных котлах.
Жировое сырьё при нагревании подвергают омылению едкой щёлочью, обычно каустической содой (гидроокисью натрия); при этом жиры превращаются в смесь солей жирных кислот и глицерин. Иногда используют жиры, предварительно подвергнутые гидролизу (расщеплению) с образованием свободных жирных кислот.
Расщеплённые жиры в варочном котле нейтрализуют кальцинированной содой (карбонатом натрия), а затем доомыляют едкой щёлочью. В обоих случаях в результате варки образуется мыльный клей однородная вязкая жидкость, густеющая при охлаждении.
Товарное мыло, полученное непосредственно из мыльного клея, называют клеевым; содержание жирных кислот в нём обычно находится в пределах от 40 до 60%. Обработка мыльного клея электролитами (отсолка) вызывает его расслоение. При полной отсолке растворами едкой щёлочи или хлористого натрия в варочном котле возникают два слоя.
Верхний слой концентрированный раствор М., содержащий не менее 60% жирных кислот, называют мыльным ядром. Из него получают товарное мыло высших сортов (ядровое мыло).
Нижний слой раствор электролита с малым содержанием мыла подмыльный щёлок; в него переходит большая часть глицерина (который извлекают как ценный побочный продукт производства) и загрязнений, внесённых в мыльный клей с исходными продуктами. Метод получения клеевых мыл принято называть прямым, ядровых косвенным. В производстве хозяйственных мыл используют оба эти метода. Туалетные мыла, как правило, готовят косвенным методом, причём мыльное ядро получают из лучшего жирового сырья и подвергают дополнительной очистке.
На втором этапе при получении твёрдых мыл мыльную массу продукт варки охлаждают, подсушивают, а затем механической обработкой с помощью специальной аппаратуры придают ей пластичность и однородность, формуют и разрезают на куски стандартной массы.
В туалетные мыла вводят отдушки, красители, антиоксиданты, а в некоторых случаях дезинфицирующие, лечебно-профилактические, пенообразующие и др. специфичные добавки. В дешёвые сорта М. иногда добавляют минеральные наполнители бентонитовые глины, очищенный каолин.
Особую группу составляют пережиренные туалетные мыла; в них отсутствует свободная щёлочь и обычно содержатся косметические добавки (высшие жирные спирты, питательные вещества и др.).
Порошкообразные мыла получают распылительной сушкой мыльных растворов. В продажу они поступают без добавок (мыльные порошки) или в смеси со значительным количеством щелочных электролитов (содой, фосфатами и др.), которые улучшают моющую способность мыла (стиральные порошки). При производстве мыла применяется автоматизированная технологическая аппаратура непрерывного действия.
Мировое производство хозяйственных мыл постепенно сокращается в связи с увеличением выпуска синтетических моющих средств и растущим дефицитом жирового сырья. Однако с распространением разнообразных синтетических мылоподобных веществ мыла не потеряли своего значения важнейшего средства личной гигиены.
Они по-прежнему широко применяются в быту и во многих отраслях промышленности (особенно в текстильной). Мыло наряду с другими типами поверхностно-активных веществ используются как смачиватели, эмульгаторы, стабилизаторы коллоидно-дисперсных систем.
Мыло применяют в составе смазочно-охлаждающих жидкостей для металлообрабатывающих станков; при обогащении полезных ископаемых флотацией. Их используют в химической технологии: при синтезе полимеров эмульсионным способом, в производстве лакокрасочной продукции и др.
«Металлические» Мыла как загустители входят в состав пластичных смазок, как сиккативы (ускорители «высыхания») в состав масляных лаков, олиф и др.
Источник: https://www.studsell.com/view/86030/
Урок по химии. 10 класс. "Все о мыле с точки зрения химика"
Закис Ирина Викторовна, учитель химии
взято от сюда: https://festival.1september.ru/articles/505442/
Слово «гигиена» происходит от греч. hygieinos, что означает «целебный, приносящий здоровье». Гигиена — это раздел профилактической медицины, изучающий влияние внешней среды на здоровье человека.
К важнейшим гигиеническим средствам следует, прежде всего, отнести мыла и моющие средства. Кроме использования мыла в качестве моющего средства оно широко применяется при отбеливании тканей, в производстве косметических средств, для изготовления полировочных составов водоэмульсионных красок. Этому веществу посвящен сегодняшний урок.
Первая группа учащихся — Историческая справка
С парфюмерией и косметикой человек знаком очень давно. Слово «парфюмерия» происходит от французского слова «парфюм», означающего приятный запах, духи.
У древних был культ косметики и гигиены тела. Уже на ранних ступенях цивилизации в Египте знали и широко применяли эфирные масла и духи, гигиенические и косметические средства для натирания тела и краски для лица. В странах Средиземноморья и на Востоке парфюмерные средства изготовляли из цветов: лилий, ирисов, нарциссов, майорана, роз.
Древние римляне для того, чтобы в жилищах был приятный запах, натирали столы мятой. А стены и полы опрыскивали её водным настоем.
Мыло было известно человеку ещё до новой эры летоисчисления,в VI веке до н.э., когда финикийцы и галлы научились варить его из козьего жира и древесной золы.
Самое раннее письменное упоминание о мыле в европейских странах встречается у римского писателя и ученого Плиния Старшего (I век н.э.). О ценности мыла в качестве очищающего средства высказывался Гален.
О профессии мыловара (сапонариуса) впервые упоминал примерно в 385 году Теодор Присцианус.
Развитию мыловарения способствовало наличие сырьевых источников. Например, марсельская мыловаренная промышленность, известная с эпохи раннего средневековья, располагала оливковым маслом и содой.
Оливковое масло (его называют ещё прованским) получают простым холодным прессованием плодов масличных деревьев. Французским мыловарам предписывалось работать только с душистыми маслами из Прованса.
Масло, получаемое после первых двух прессовок, употребляли для пищевых целей, а после третьего – использовали на переработку, на мыло. Марсельское мыло было предметом торговли уже в IX веке. Оно уступило своё место в международной торговле венецианскому мылу лишь в XIV веке.
Кроме Франции, мыловарение в Европе развивалось в Италии, Греции, Испании, на Кипре, то есть в районах, где росли оливковые деревья. Первые германские мыловарни были основаны в XIV столетии.
Несмотря на то, что в конце эпохи средневековья в разных странах существовала довольная развитая мыловаренная промышленность, химическая сущность процессов, была, конечно, не ясна. Лишь на рубеже XVIII-XIX вв. была установлена химическая природа жиров и внесена ясность в реакцию их омыления. В 1779 г. шведский химик К.-В.
Шееле (1742-1786) показал, что при взаимодействии оливкового масла с оксидом свинца и водой образуется сладкое, растворимое в воде вещество. Решающий шаг на пути изучения химической природы жиров был сделан французским химиком М.-Э. Шеврелем (1786-1889). Он отрыл стеариновую, пальмитиновую и олеиновую кислоты как продукты разложения жиров при их омылении водой и щелочами.
Сладкое вещество. Полученное Шееле, было названо Шеврелем глицерином. Сорок лет спустя П.-Э. Бертло (1827-1907) установил природу глицерина и объяснил химическое строение жиров. Глицерин – трехатомный спирт.
Жиры – сложные эфиры глицерина и высших одноосновных карбоновых кислот, преимущественно пальмитиновой СН3(СН2)14СООН, стеариновой СН3(СН2)16СООН и олеиновой СН3(СН2)7СН=СН (СН2)СООН, а мылами называют натриевые или калиевые соли этих кислот.
Области применения мыла
Кроме использования мыла в качестве моющего средства оно широко применяется при отбеливании тканей, в производстве косметических средств, для изготовления полировочных составов водоэмульсионных красок.
В быту, не говоря уже о промышленности, процессу мытья подвергают разные предметы и объекты. Загрязняющие вещества бывают самые разнообразные, но чаще всего они малорастворимые или нерастворимые в воде. Такие вещества, как правило, являются гидрофобными, поскольку водой не смачиваются и с водой не взаимодействуют. Поэтому нужны и различные моющие средства.
Если попытаться дать этому процессу определения, то мытьём можно назвать очистку загрязненной поверхности жидкостью, содержащей моющее вещество или систему моющих веществ. В качестве жидкости в быту используют главным образом воду. Хорошая моющая система должна выполнять двойную функцию: удалять загрязнение с очищаемой поверхности и переводить его в водный раствор.
Значит, моющее средство также должно обладать двойной функцией: способностью взаимодействовать с загрязняющим веществом и свойством переводить его в воду или водный раствор. Следовательно, молекула моющего вещества должна иметь гидрофобную и гидрофильную части. «Фобос» по-гречески означает страх. Боязнь. Значит, гидрофобный означает «боящийся, избегающий воду».
«Филео» по-гречески – «люблю», гидрофильный – любящий. Удерживающий воду. Гидрофобная часть молекулы моющего вещества обладает способностью взаимодействовать с поверхностью гидрофобного загрязняющего вещества.
Гидрофильная часть моющего средства взаимодействует с водой , проникает в воду и увлекает за собой частицу загрязняющего вещества, присоединенную к гидрофобному концу.
Таким образом, моющие вещества должны обладать способностью адсорбироваться на пограничной поверхности, то есть обладать поверхностно-активными веществами (ПАВ).
Соли тяжелых карбоновых кислот, например СН3(СН2)14СООNa, являются типичными поверхностно-активными веществами. Они содержат гидрофильную часть (в данном случае – карбоксильную группу) и гидрофобную часть (углеводородный радикал).
Свойства мыл
Мыла – соли высокомолекулярных жирных кислот.
В технике мылами называют натриевые или калиевые соли высших жирных кислот, в молекулах которых содержится не менее 8 и не более 20 углеродных атомов, а также подобных им кислот нафтеновых и смоляных (канифоли); водные растворы таких солей обладают поверхностно-активными и моющими свойствами. Соли щёлочноземельных и тяжёлых металлов условно называют металлическими мылами; большинство из них не растворимо в воде.
В безводном состоянии натриевые и калиевые соли жирных кислот представляют собой твёрдые кристаллические вещества с toпл. 220о-270о. Безводные мыла, особенно калиевые, гигроскопичны; причём соли жирных непредельных кислот в большей степени гигроскопичны, чем соли предельных.
В горячей воде при температуре, близкой к точке кипения, мыла растворяются во всех отношениях; при средних комнатных температурах растворимость их ограничена и зависит от природы и состава кислот и щелочей.
Мыла, в состав которых входят в большом количестве соли высокомолекулярных твёрдых жирных кислот, в холодной воде плохо пенятся и обладают низкой моющей способностью, тогда как мыла из жидких масел, а также из твёрдых низкомолекулярных жирных кислот, например кокосового масла, хорошо моют при комнатной температуре.
Мыла, являясь солями щелочных металлов и слабых органических кислот, при растворении в воде подвергаются гидролизу с образованием свободной щёлочи и кислот, а также кислых солей, которые для большинства жирных кислот представляют труднорастворимые осадки, сообщающие растворам мутность.
Для солей различных жирных кислот гидролиз увеличивается с повышением их молекулярного веса, с уменьшением концентрации мыла и с увеличением температуры раствора. Вследствие гидролиза водные растворы даже нейтральных мыл имеют щелочную реакцию. Спирт подавляет гидролиз мыл.
Количественные соотношения между продуктами гидролиза водных растворов мыл находятся в зависимости от концентрации и температуры.
Мыла в водных растворах находятся частью в состоянии истинного раствора, частью же в коллоидном полидисперсном состоянии, образуя сложную систему, состоящую из молекул и мицелл нейтрального мыла, его ионов и других продуктов гидролиза. С уменьшением полярности растворителя, т.е.
с переходом от воды к органическим жидкостям, например к спирту, коллоидные свойства растворов мыл уменьшаются. Растворимость мыл в метиловом и этиловом спирте значительно выше, чем в воде, причём в безводных спиртах мыло находится в состоянии истинного раствора.
Концентрированные растворы мыл твёрдых жирных кислот в этиловом спирте, приготовленные при нагревании, дают при охлаждении твёрдые гели, чем пользуются в технике для приготовления так называемого твёрдого спирта. В безводном эфире и бензине мыла почти нерастворимы. Растворимость кислых мыл в бензине и других углеводородных жидкостях значительно выше, чем нейтральных. Соли щелочноземельных металлов высших жирных кислот, а также соли тяжёлых металлов в воде нерастворимы. Металлические мыла растворяются в жирах, чем пользуются в производстве олиф, где эти мыла как катализаторы ускоряют процесс высыхания жирных масел. Растворимость мыл в минеральных маслах используется в технике при производстве консистентных смазок (солидолов).
Широкое применение мыл как моющих средств, смачивателей, эмульгаторов, пептизаторов, смазочных средств и активных понизителей твёрдости тел, например, при резании металлов, объясняется специфичным строением их молекул. Мыла являются типичными поверхностно-активными веществами.
Классификация мыл
Мыла классифицируют на хозяйственные, туалетные и специальные. Хозяйственными, или стирочными, называют мыла твёрдой консистенции, состоящие в основном из натриевых солей жирных, смоляных (канифольных) и нафтеновых кислот; они могут содержать различные органические и неорганические добавки, улучшающие качество.
По способу приготовления различают ядровые, клеевые и полуядровые мыла. Ядровое мыло – технически чистое мыло, полученное путем высаливания концентрированного мыльного раствора, так называемого мыльного клея, поваренной солью с выделением «ядровой» части. Ядро содержит жирных и подобных кислот не менее 60%.
Клеевым называют мыло, получаемое в результате затвердения мыльного клея в стадии начавшегося разделения его на ядровую и клеевую части, что придаёт готовому продукту мраморную структуру, особенно после добавления ультрамарина; содержит не менее 47% жирных кислот.
Туалетное мыло обладает высоким моющим действием и даёт обильную пену в воде средней жесткости при комнатных температурах; оно должно иметь приятный запах, цвет, форму и не оказывать вредного и раздражающего действия на кожу.
Главная масса туалетного мыла вырабатывается из ядрового мыла, в жировую рецептуру которого входит кокосовое масло, после предварительной подсушки, окраски и парфюмирования ароматическими веществами. Для этого подсушенное, замешанное с краской и ароматическими веществами ядровое мыло превращают в тонкую мыльную ленту.
Полученные ленты прессуют в плотные и однородные мыльные брусья, их которых штампуют отдельные куски. Туалетное мыло содержит не менее 72% жирных кислот.
К специальным мылам относятся медицинское, содержащие различные лечебные и дезинфицирующие вещества, например сернодегтярное мыло содержит 5,5% серы 2% дёгтя, ихтиоловое с 5% ихтиола и др.
к медицинским мылам относится также жидкое калиевое мыло, которое приготовляется из жидких растительных масел путём омыления их едким кали; содержание жирных кислот не менее 40%.
Медицинское мыло, применяемое наружно в формах пластырей, мазей, паст, имеет терапевтическое значение в соответствии с влиянием прибавляемого к мылу действующего начала. Таково применение терпентинного мыла в форме мази при ревматизме.
К специальным видам мыла также принадлежат мыла, применяемые большей частью в текстильной, кожевенной, металлургической промышленности, в производстве инсектофунгицидов и т.д. специальные мыла известны главным образом в виде жидких, приготовляемых путём омыления жировой смеси натровыми или калиевыми щелочами или их смесью.
Сырье для производства мыла
Животные жиры – древнее и весьма ценное сырьё мыловаренной поверхности. Они содержат до 40 % насыщенных жирных кислот. Искусственные, то есть синтетические, жирные кислоты получают из парафина нефти каталитическим окислением кислородом воздуха.
Молекула парафина при окислении разрывается в разных местах, и получается смесь кислот, которые затем разделяются на фракции. При производстве мыла используют в основном две фракции: С10-С16 и С17-С20.
В хозяйственное мыло синтетические кислоты вводят в количестве 35-40 %.
Для производства мыла применяют также нафтеновые кислоты, выделяемые при очистки нефтепродуктов (бензина, керосина и др.).
с этой целью нефтепродукты обрабатываются раствором гидроксида натрия и получают водный раствор натриевых солей нафтеновых кислот (монокарбоновые кислоты ряда циклопентана и циклогексана).
Этот раствор упаривают и обрабатывают поваренной солью, в результате чего на поверхность раствора всплывает мазеобразная масса тёмного цвета – мылонафт. Для очистки мылонафта обрабатывают серной кислотой, то есть вытесняют из солей сами нафтеновые кислоты.
Этот нерастворимый в воде продукт называют асидолом, или асидолмылонафтом. Непосредственно из асидола можно изготавливать только жидкое или, в крайнем случае, мягкое мыло. Оно имеет нефтяной запах, но зато обладает бактерицидными свойствами.
В производстве мыла давно используют канифоль, которую получают при переработки живицы хвойных деревьев.
Канифоль состоит из смеси смоляных кислот, содержащих в углеродной цепи около 20 атомов углерода.
в состав хозяйственного мыла обычно вводят 12-15 % канифоли от массы жирных кислот, а в рецептуру туалетных мыл – не более 10 %. Введение канифоли в больших количествах делает мыло мягким и липким.
Технология приготовление мыла в домашних условиях
Для того чтобы приготовить мыло в домашних условиях необходимо соблюдать следующую последовательность операций:
- Наполнить стакан на ½ водой, поставить на треножник с металлической сеткой и вскипятить воду.
- Налить в чашку для выпаривания касторовое масло и раствор гидроксида натрия.
- Поставить чашку для выпаривания на стакан с кипящей водой и нагревать в течении 10-15 минут, перемешивая её содержимое стеклянной палочкой.
- Добавить насыщенный раствор хлорида натрия и перемешать.
- Чашку с содержимым охладить.
- С помощью шпателя собрать мыло, слепить из него два кусочка размером с рисовое зернышко.
- Ароматизировать полученное мыло можно с помощью растительных вытяжек, используя для этой цели такие растения : листья смородины, иголочки хвои, цветки календулы, ромашки.
- Изучение свойств мыла
- Для изучения свойств мыла необходимо провести ряд опытов, подтверждающих его моющие свойства. Для этого следует:
- В одну пробирку налить 5 мл дистиллированной воды, в другую – столько же водопроводной, поместить в каждую по кусочку мыла.
- Закрыть пробками и встряхивать обе пробирки одновременно в течение нескольких секунд.
- Поставить пробирки в штатив и с помощью секундомера определить, как долго пена остаётся в каждой пробирке.
- Отметить вид содержимого каждой пробирки.
- С помощью универсальной индикаторной бумаги определить кислотность мыльного раствора.
- Наличие глицерина в реакционной смеси можно обнаружить при помощи качественной реакции на многоатомные спирты, т.е. добавлением свежеприготовленного гидроксида меди.
Выводы по экспериментальной части урока:
- мыло, полученное в домашних условиях, хорошо пенится;
- мыло имеет слабощелочную реакцию среды;
- дает характерную реакцию на содержание глицерина.
Литература:
- Богданова Н.Н. Химия. Лабораторные работы. 8 – 11 кл.: Учеб. пособие для общеобразовательных учреждений. – М.: ООО «Издательство Астрель»: ООО «Издательство АСТ», 2001. – 112с.: ил.
- Большая советская энциклопедия ( в 30 томах). Гл. ред. А.М. Прохоров. Изд. 3-е М., «Советская Энциклопедия». 1972.Т.17 Моршанск – Мятлик. 1974.616с.
- Химия. 9 класс: Сборник элективных курсов / Сост.Н.В. Ширшина. – Волгоград: Учитель, 2005. 97-103 с.
- Я познаю мир: Детская энциклопедия: Химия / Авт. – сост. Л.А. Савина; Худож. А.В. Кардашук, О.М. Войтенко. – М.: ООО «Фирма «Издательство АСТ»; 1999. – 448с.
И еще возможность посетить урок Химии — https://www.alhimik.ru/read/grosse21.html
Интересное обсуждение процессов растворения грязи и нулевого мыла в жесткой воде. https://www.chemport.ru/forum/viewtopic.php?f=4&t=29108&start=20
Источник: https://lilyaschik.livejournal.com/19015.html