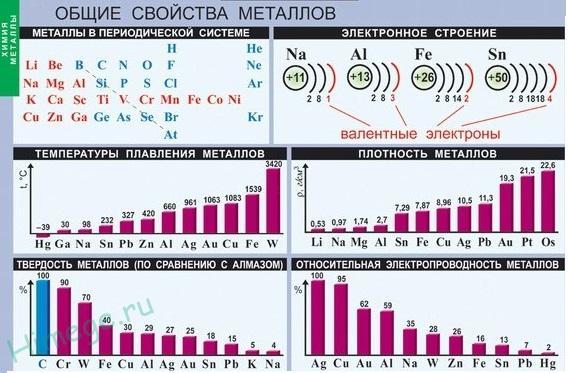
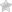Из (118) известных на данный момент химических элементов (96) образуют простые вещества с металлическими свойствами, поэтому их называют металлическими элементами.
Металлические химические элементы в природе могут встречаться как в виде простых веществ, так и в виде соединений. То, в каком виде встречаются металлические элементы в природе, зависит от химической активности образуемых ими металлов.
Ряд активности металлов
| (Li, K, Ba, Ca, Na, ) | (Mg, Al, Mn, Zn, Cr, Fe, Ni, Sn, Pb) | H2 | (Cu, Hg, Ag, Pt, Au) |
| активныеметаллы | металлы среднейактивности | неактивныеметаллы |
Металлические элементы, образующие химически активные металлы (Li–Mg), в природе чаще всего встречаются в виде солей (хлоридов, фторидов, сульфатов, фосфатов и других).
Соли, образуемые этими металлами, являются главной составной частью распространённых в земной коре минералов и горных пород.
 |
 |
 |
| Сильвин — хлорид калияKCl с примесями |
|
|
В растворённом виде соли натрия, кальция и магния содержатся в природных водах. Кроме того, соли активных металлов — важная составная часть живых организмов. Например, фосфат кальция Ca3(PO4)2 является главной минеральной составной частью костной ткани.
Металлические химические элементы, образующие металлы средней активности (Al–Pb), в природе чаще всего встречаются в виде оксидов и сульфидов.
 |
 |
 |
|
|
|
Металлические элементы, образующие химически неактивные металлы (Cu–Au), в природе чаще всего встречаются в виде простых веществ.
 |
 |
 |
| Самородное золото Au | Самородное серебро Ag | Самородная платина Pt |
Исключение составляют медь и ртуть, которые в природе встречаются также в виде химических соединений.
 |
||
|
|
|
Положение элементов металлов в Периодической системе, особенности строения и свойств их атомов
В Периодической системе химических элементов металлы занимают левый нижний угол и находятся в главных (А) и побочных (Б) группах.
Открыть таблицу в большом размере
Положение металлов в Периодической системе. Знаки металлических химических элементов выделены красным цветом
В электронной оболочке атомов металлов на внешнем энергетическом уровне, как правило, содержится от (1) до (3) электронов. Исключение составляют только металлы (IV)А, (V)А и (VI)А группы, у которых на наружном энергетическом уровне находятся соответственно четыре, пять или шесть электронов.
Радиусы атомов металлов больше, чем у атомов неметаллов того же периода. В силу отдалённости положительно заряженного ядра атомы металлов слабо удерживают свои валентные электроны (электроны внешнего энергетического уровня).
Характер изменения радиусов атомов химических элементов в периодах и в группах. Радиусы атомов металлов существенно больше, чем радиусы атомов неметаллов, находящихся в том же периоде
Главное отличительное свойство металлов — это их сравнительно невысокая электроотрицательность (ЭО) по сравнению с неметаллами.
Величины относительных электроотрицательностей (ОЭО) некоторых химических элементов (по Л. Полингу). ОЭО металлических химических элементов (выделены красным цветом) уступает соответствующей величине неметаллических химических элементов
Атомы металлов, вступая в химические реакции, способны только отдавать электроны, то есть окисляться, следовательно, в ходе превращений могут проявлять себя в качестве восстановителей.
Источник: https://www.yaklass.ru/p/himija/89-klass/klassy-neorganicheskikh-veshchestv-14371/metally-15154/re-687935b4-cd8a-4f4a-9816-f5b2d95c1b1d
Презентация по химии 9 класс по теме "Свойства металлов"
Инфоурок › Химия ›Презентации›Презентация по химии 9 класс по теме «Свойства металлов»










Описание презентации по отдельным слайдам:
1 слайд Описание слайда:
Презентация по химии Положение металлов в периодической системе химических элементов Д.И. Менделеева. Металлическая кристаллическая решетка и металлическая химическая связь. Общие физические свойства металлов. Выполнила учитель высшей квалификационной категории МКОУ СОШ № 10 г. Бирюсинска Федотова Марина Владимировна г. Бирюсиснск, 2015 *
2 слайд Описание слайда:
Образовательный портал «Мой университет» — www.moi-universitet.ru Факультет «Реформа образования» — www.edu-reforma.ru
3 слайд Описание слайда:
Положение металлов в периодической системе химических элементов Д.И. Менделеева. Металлическая кристаллическая решетка и металлическая химическая связь. Общие физические свойства металлов. Образовательный портал «Мой университет» — www.moi-universitet.ru Факультет «Реформа образования» — www.edu-reforma.ru
4 слайд Описание слайда:
Эпиграф урока: «Мощь и сила науки – во множестве фактов, цель – в обобщении этого множества» Д.И.Менделеев Образовательный портал «Мой университет» — www.moi-universitet.ru Факультет «Реформа образования» — www.edu-reforma.ru
5 слайд Описание слайда:
Удивительный мир металлов Образовательный портал «Мой университет» — www.moi-universitet.ru Факультет «Реформа образования» — www.edu-reforma.ru
6 слайд Описание слайда:
Цели урока: Рассмотреть положение металлов в ПСХЭ; Выяснить особенности строения атомов металлов; Познакомиться с физическими свойствами металлов; Выяснить, от чего зависят физические свойства; Рассмотреть, как связаны физические свойства и использование металлов. Образовательный портал «Мой университет» — www.moi-universitet.ru Факультет «Реформа образования» — www.edu-reforma.ru
7 слайд Описание слайда:
Из 109 элементов ПСХЭ ? являются металлами: они выделены голубым, зелёным и розовым цветом (кроме H и He) Образовательный портал «Мой университет» — www.moi-universitet.ru Факультет «Реформа образования» — www.edu-reforma.ru
8 слайд Описание слайда:
Положение металлов в Периодической системе химических элементов Условная граница между элементами-металлами и элементами-неметаллами проходит по диагонали: B(бор) – Si(кремний) – As(мышьяк) –Te(теллур) – At (астат) Образовательный портал «Мой университет» — www.moi-universitet.ru Факультет «Реформа образования» — www.edu-reforma.ru
9 слайд Описание слайда:
Малое количество электронов на внешнем слое (в основном от 1 до 3) и сравнительно большие радиусы атомов элементов-металлов способствуют тому, что они отдают электроны внешнего (и предвнешнего) электронного слоя, превращаясь в положительно заряженные ионы. В главной подгруппе: -радиус атома увеличивается; -восстановительные свойства усиливаются; -металлические свойства усиливаются. В периоде: -радиус атома уменьшается; -восстановительные свойства уменьшаются; -металлические свойства ослабевают.
10 слайд Описание слайда:
Загадочная пауза Он в теченье многих лет был причиной многих бед. Был металл серебристо-белым, в соединении стал мелом. К восьмой группе отнесен, в честь России назван он. «Камнем» назван он людьми, но попробуй-ка возьми. Из него солдатик твой, не болеет он «чумой».
11 слайд Описание слайда:
Кристаллическая решетка Металлическими называют решётки, в узлах которых находятся атомы и ионы металла, между ними свободные (обобществленные) электроны.
12 слайд Описание слайда:
Кристаллические решетки металлов
13 слайд Описание слайда:
Физические свойства металлов Агрегатное состояние (твердость) Пластичность Электрическая проводимость Теплопроводность Металлический блеск Плотность
14 слайд Описание слайда:
Пластичность Смещение слоев в кристаллических решетках металлов при механическом воздействии
15 слайд Описание слайда:
Плотность металлов r, г/см3
16 слайд Описание слайда:
Температура плавления металлов Металлы подразделяют на следующие группы: легкоплавкие (ртуть, цезий, цинк, олово, свинец, висмут и др.); среднеплавкие (к ним относятся почти половина металлов, в том числе магний, алюминий, железо, никель, медь, золото); тугоплавкие (вольфрам, молибден, титан, хром и др.). t, °C
17 слайд Описание слайда:
Металл галлий, твердый слиток которого лежит на столе, имеет низкую температуру плавления и становится жидким от тепла руки.
18 слайд Описание слайда:
Твердость металлов Твердость – это характеристика металла, отражающая его прочность и пластичность. Количественной оценкой является число твердости (НВ). Значения твердости некоторых металлов по Бринеллю приведены на диаграмме. HB
19 слайд
20 слайд Описание слайда:
Философский камень (ребис) — в описаниях средневековых алхимиков некоторый химический реактив, необходимый для успешного осуществления превращения (так называемой трансмутации) металлов в золото.
Раствор его, так называемый золотой напиток (аurum potabile), принятый внутрь в малых дозах, должен был исцелять все болезни, молодить старое тело и делать жизнь более продолжительной.
Другое таинственное средство, носившее название белого льва или белой тинктуры, ограничивалось способностью превращать в серебро все неблагородные металлы.
21 слайд Описание слайда:
Усопшим царского происхождения надевали на лицо золотые маски, в то время как простые люди должны были довольствоваться желтой краской. Гробницу фараона, богато украшенную золотом, называли «золотой дом».
С давних времен золото считалось металлом богов, особенно бога солнца. Бога солнца Ра называли также «золотая гора, которая озаряет землю».
В представлении египтян тела богов были из чистого золота, и сам металл мог придавать божественные способности тому, кто его носил.
22 слайд Описание слайда:
Калифорнийская золотая лихорадка (1848—1855) началась в январе 1848, когда золото было обнаружено вблизи лесопилки на реке Американ-Ривер. Как только новость об обнаружении распространилась, около 300 тысяч человек прибыли в Калифорнию из других штатов.
Золотая лихорадка также привлекла десятки тысяч добровольцев из стран Латинской Америки, Европы, Австралии и Азии. Было обнаружено золото на сумму в несколько миллиардов сегодняшних долларов, что привело к увеличению состояния некоторых старателей.
Другие, однако, вернулись домой с пустыми руками.
23 слайд Описание слайда:
В зависимости от цвета, в золотой сплав входят следующие металлы: Белое золото – палладий, никель, платина Красное золото – серебро, медь Желтое золото – серебро, медь (в другом процентном соотношении) Белое золото – палладий, никель, платина
24 слайд Описание слайда:
Чистое золото — мягкий металл жёлтого цвета. В тонких плёнках золото просвечивает зелёным. Золото обладает исключительно высокой теплопроводностью и низким сопротивлением. Золото – очень тяжелый металл: шар из чистого золота диаметром 46 мм имеет массу 1 кг.
Литровая бутыль, заполненная золотым песком, весит приблизительно 16 кг. Золото очень ковко и тягуче. Из кусочка золота весом в один грамм можно вытянуть проволоку длиной в три километра или изготовить золотую фольгу в 500 раз тоньше человеческого волоса (0,0001 мм).
Мягкость чистого золота настолько велика, что его можно царапать ногтем.
25 слайд Описание слайда:
По своей химической стойкости и механической прочности золото уступает большинству платиноидов, но незаменимо, как материал для электрических контактов. Поэтому в микроэлектронике золотые проводники и гальванические покрытия используются очень широко.
Золото используется в качестве мишени в ядерных исследованиях, в качестве покрытия зеркал, работающих в дальнем инфракрасном диапазоне, в качестве специальной оболочки в нейтронной бомбе. Золотые припои очень хорошо смачивают различные металлические поверхности и применяются при пайке металлов.
Золочение металлов широко используется в качестве метода защиты от коррозии. Золото зарегистрировано в качестве пищевой добавки Е175.
26 слайд Описание слайда:
Золото может быть в умелых руках гибким и податливым, как воск…
27 слайд Описание слайда:
«Золото ослепительно блестело, скульптура выглядела так, как будто ее только что принесли из мастерской… Лицо ее было сделано из чистого золота, глаза из аргонита и обсидиана, брови и веки — из стекла цвета лазурита.
Это лицо напоминало своей неподвижностью маску, и в то же время оно было словно живое». Это описание золотой маски, покрывающей мумию фараона Тутанхамона, принадлежит перу К. Керама, автора книги «Боги, гробницы и ученые».
28 слайд Описание слайда:
Золото привлекало своим солнечным блеском. Золото блестит даже в темную, серую погоду, показывает повсюду победу сил света над силами тьмы.
29 слайд Описание слайда:
Медь История цивилизаций Древнего Египта, Древней Греции, Вавилона и других государств неразрывно связанна с историей металлов и их сплавов. Установлено, что египтяне за несколько тысячелетий до нашей эры уже умели изготавливать изделия из меди
30 слайд Описание слайда:
В синем небе, колокольнями проколотом, – Медный колокол, медный колокол, – То ль возрадовался, то ли осерчал… В. Высоцкий
31 слайд Описание слайда:
Православный храм в Бирюсинске Колокольня храма Воскресения Господня в г. Бирюсинске
32 слайд Описание слайда:
Физические свойства меди Медь – тягучий вязкий металл светло-розового света, легко прокатываемый в тонкие листы. Она очень хорошо проводит теплоту и электрический ток. Отличается хорошими литейными качествами.
33 слайд Описание слайда:
2 млн 300 тыс. каменных глыб, из которых сложена пирамида Хеопса, добыты и обтесаны медным инструментом…
34 слайд Описание слайда:
Из представителей животного мира наибольшее количество меди содержат устрицы, осьминоги и некоторые моллюски. Медь входит в состав их дыхательного пигмента – гемоцианина.
35 слайд Описание слайда:
У меди было много преимуществ перед камнем и деревом. Во-первых это ковкость и плавкость. Металл поддавался любой обработке и принимал нужную форму. Во-вторых это более эффективный материал. Ведь разрубить дерево проще медным топором, чем долбить камнем. А в-третьих это возможность дальнейшего развития для человека, шанс встать на новую ступень развития.
36 слайд Описание слайда:
Медь применялась в изготовлении предметов искусства.
37 слайд Описание слайда:
Всего этого человек не достиг бы, если бы не открыл свойства меди. Благодаря ним он смог намного улучшить орудия труда, усовершенствовать свои ремёсла, что сильно ускорило прогресс и дало начало новому веку.
38 слайд Описание слайда:
«Век 19, железный, Воистину жестокий век! Тобою в мрак ночной, беззвездный Беспечный брошен человек!» (А.Блок)
39 слайд Описание слайда:
Физические свойства Железо — сравнительно мягкий ковкий серебристо-серый металл. Температура плавления – 1535 0С Температура кипения около 2800 0С При температуре ниже 770 0С железо обладает ферромагнитными свойствами (оно легко намагничивается, и из него можно изготовить магнит). Выше этой температуры ферромагнитные свойства железа исчезают, железо «размагничивается».
40 слайд Описание слайда:
Метеориты, украшения, монеты из железа
41 слайд Описание слайда:
Памятник железу – Эйфелева башня
42 слайд Описание слайда:
Биологическая роль железа Железо играет важную роль в жизнедеятельности живых организмов. Оно входит в состав гемоглобина крови, соединения железа применяют для лечения малокровия, истощении, упадке сил. Основным источником железа для человека является пища. Его много в зеленых овощах, мясе, сухофруктах, шоколаде.
43 слайд Описание слайда:
Значение железа: гемоглобин крови
44 слайд Описание слайда:
Какой металл самый-самый? Самый легкий металл – Li (ρ =0,53 г/см3). Самый тяжелый металл – Os (ρ=22,5 г/см3). Самый легкоплавкий металл – Hg (tпл = –38,87 °С). Самый тугоплавкий металл – W (tпл = 3410 °С). Самый мягкий металл – Cs. Самый твердый металл – Cr.
45 слайд Описание слайда:
Проверь свои знания Вопрос № 1 Какому металлу соответствует строение атома 2е, 8е, 2е Na Mg Li
46 слайд Описание слайда:
Вопрос № 2 Пластичность металлов обусловлена: Смещением слоев в кристалле относительно друг друга. Жидким агрегатным состоянием; Не большим атомным радиусом
47 слайд Описание слайда:
Вопрос № 3 Какие частицы находятся в узлах металлической кристаллической решетки Электроны; Атомы; Атомы и ион — металлы
48 слайд Описание слайда:
Вопрос № 4 На внешнем энергетическом уровне металлов находится; 3-5 электронов; 1-3 электрона; 2-4 электрона
49 слайд Описание слайда:
Вопрос № 5 Атомам металлов характерна: Восстановительная способность (отдавать внешние электроны); Окислительная способность (принимать внешние электроны); В реакциях инертны
50 слайд Описание слайда:
КЛЮЧ К ТЕСТУ 1-2 2-1 3-3 4-2 5-1
51 слайд Описание слайда:
Рефлексия Я узнал (а) много нового. Мне это пригодится в жизни. На уроке было над чем, подумать. На все возникшие у меня в ходе урока вопросы я получил (а) ответы. На уроке я поработал (а) добросовестно и цели урока достиг(ла).
52 слайд Описание слайда:
Домашнее задание: Параграф 5,6 составить ребусы или загадки про металлы, сообщения про сплавы меди и железа, составить презентацию по теме «Сплавы»
53 слайд Описание слайда:
Спасибо за работу!
Скрыть
Важно! Узнайте, чем закончилась проверка учебного центра «Инфоурок»?
Общая информация
Оставьте свой комментарий
Авторизуйтесь, чтобы задавать вопросы.
Источник: https://infourok.ru/prezentaciya-po-himii-klass-po-teme-svoystva-metallov-785400.html
Общая характеристика металлов
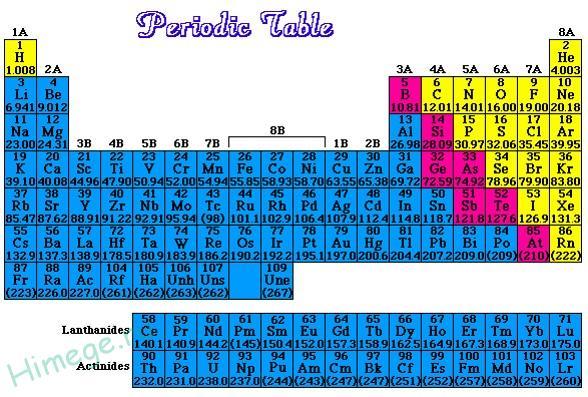 Если в периодической таблице элементов Д.И.Менделеева провести диагональ от бериллия к астату, то слева внизу по диагонали будут находиться элементы-металлы (к ним же относятся элементы побочных подгрупп, выделены синим цветом), а справа вверху – элементы-неметаллы (выделены желтым цветом). Элементы, расположенные вблизи диагонали – полуметаллы или металлоиды (B, Si, Ge, Sb и др.), обладают двойственным характером (выделены розовым цветом).
Если в периодической таблице элементов Д.И.Менделеева провести диагональ от бериллия к астату, то слева внизу по диагонали будут находиться элементы-металлы (к ним же относятся элементы побочных подгрупп, выделены синим цветом), а справа вверху – элементы-неметаллы (выделены желтым цветом). Элементы, расположенные вблизи диагонали – полуметаллы или металлоиды (B, Si, Ge, Sb и др.), обладают двойственным характером (выделены розовым цветом).
Как видно из рисунка, подавляющее большинство элементов являются металлами.
По своей химической природе металлы – это химические элементы, атомы которых отдают электроны с внешнего или предвнешнего энергетического уровней, образуя при этом положительно заряженные ионы.
Практически все металлы имеют сравнительно большие радиусы и малое число электронов (от 1 до 3) на внешнем энергетическом уровне. Для металлов характерны низкие значения электроотрицательности и восстановительные свойства.
Наиболее типичные металлы расположены в начале периодов (начиная со второго), далее слева направо металлические свойства ослабевают. В группе сверху вниз металлические свойства усиливаются, т.
к увеличивается радиус атомов (за счет увеличения числа энергетических уровней).
Это приводит к уменьшению электроотрицательности (способности притягивать электроны) элементов и усилению восстановительных свойств (способность отдавать электроны другим атомам в химических реакциях).
Типичными металлами являются s-элементы (элементы IА-группы от Li до Fr. элементы ПА-группы от Мg до Rа). Общая электронная формула их атомов ns1-2. Для них характерны степени окисления + I и +II соответственно.
Небольшое число электронов (1-2) на внешнем энергетическом уровне атомов типичных металлов предполагает легкую потерю этих электронов и проявление сильных восстановительных свойств, что отражают низкие значения электроотрицательности. Отсюда вытекает ограниченность химических свойств и способов получения типичных металлов.
Характерной особенностью типичных металлов является стремление их атомов образовывать катионы и ионные химические связи с атомами неметаллов.
Соединения типичных металлов с неметаллами — это ионные кристаллы «катион металлаанион неметалла», например К+ Вг—, Сa2+ О2-.
Катионы типичных металлов входят также в состав соединений со сложными анионами — гидроксидов и солей, например Мg2+(OН—)2, (Li+)2СO32-.
Металлы А-групп, образующие диагональ амфотерности в Периодической системе Ве-Аl-Gе-Sb-Ро, а также примыкающие к ним металлы (Gа, In, Тl, Sn, Рb, Вi) не проявляют типично металлических свойств.
Общая электронная формула их атомов ns2np0-4 предполагает большее разнообразие степеней окисления, большую способность удерживать собственные электроны, постепенное понижение их восстановительной способности и появление окислительной способности, особенно в высоких степенях окисления (характерные примеры — соединения Тl III, РbIV, Вiv).
Подобное химическое поведение характерно и для большинства (d-элементов, т. е. элементов Б-групп Периодической системы (типичные примеры — амфотерные элементы Сr и Zn).
Это проявление двойственности (амфотерности) свойств, одновременно металлических (основных) и неметаллических, обусловлено характером химической связи. В твердом состоянии соединения нетипичных металлов с неметаллами содержат преимущественно ковалентные связи (но менее прочные, чем связи между неметаллами).
В растворе эти связи легко разрываются, а соединения диссоциируют на ионы (полностью или частично).
Например, металл галлий состоит из молекул Ga2, в твердом состоянии хлориды алюминия и ртути (II) АlСl3 и НgСl2 содержат сильно ковалентные связи, но в растворе АlСl3 диссоциирует почти полностью, а НgСl2 — в очень малой степени (да и то на ионы НgСl+ и Сl—).
Общие физические свойства металлов
Благодаря наличию свободных электронов («электронного газа») в кристаллической решетке все металлы проявляют следующие характерные общие свойства:
1) Пластичность — способность легко менять форму, вытягиваться в проволоку, прокатываться в тонкие листы.
2) Металлический блеск и непрозрачность. Это связано со взаимодействием свободных электронов с падающими на металл светом.
3) Электропроводность. Объясняется направленным движением свободных электронов от отрицательного полюса к положительному под влиянием небольшой разности потенциалов. При нагревании электропроводность уменьшается, т.к. с повышением температуры усиливаются колебания атомов и ионов в узлах кристаллической решетки, что затрудняет направленное движение «электронного газа».
4) Теплопроводность. Обусловлена высокой подвижностью свободных электронов, благодаря чему происходит быстрое выравнивание температуры по массе металла. Наибольшая теплопроводность — у висмута и ртути.
5) Твердость. Самый твердый – хром (режет стекло); самые мягкие – щелочные металлы – калий, натрий, рубидий и цезий – режутся ножом.
6) Плотность. Она тем меньше, чем меньше атомная масса металла и больше радиус атома. Самый легкий — литий (ρ=0,53 г/см3); самый тяжелый – осмий (ρ=22,6 г/см3). Металлы, имеющие плотность менее 5 г/см3 считаются «легкими металлами».
7) Температуры плавления и кипения. Самый легкоплавкий металл – ртуть (т.пл. = -39°C), самый тугоплавкий металл – вольфрам (t°пл. = 3390°C). Металлы с t°пл. выше 1000°C считаются тугоплавкими, ниже – низкоплавкими.
Общие химические свойства металлов
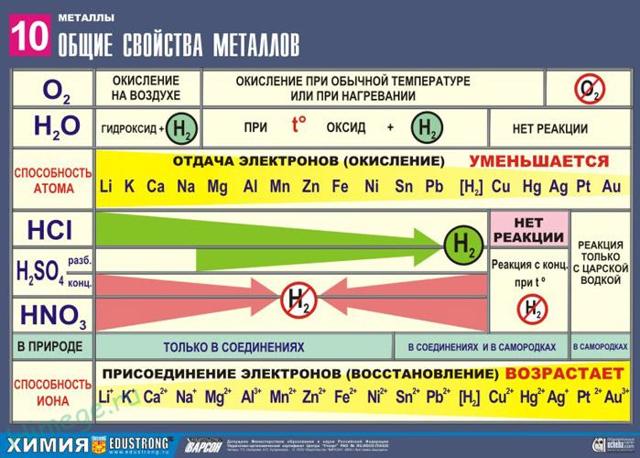
Сильные восстановители: Me0 – nē → Men+
Ряд напряжений характеризует сравнительную активность металлов в окислительно-восстановительных реакциях в водных растворах.
I. Реакции металлов с неметаллами
- 1) С кислородом:
2Mg + O2 → 2MgO - 2) С серой:
Hg + S → HgS - 3) С галогенами:
Ni + Cl2 –t°→ NiCl2 - 4) С азотом:
3Ca + N2 –t°→ Ca3N2 - 5) С фосфором:
3Ca + 2P –t°→ Ca3P2 - 6) С водородом (реагируют только щелочные и щелочноземельные металлы):
2Li + H2 → 2LiH - Ca + H2 → CaH2
II. Реакции металлов с кислотами
- 1) Металлы, стоящие в электрохимическом ряду напряжений до H восстанавливают кислоты-неокислители до водорода:
- Mg + 2HCl → MgCl2 + H2
- 2Al+ 6HCl → 2AlCl3 + 3H2
- 6Na + 2H3PO4 → 2Na3PO4 + 3H2
- 2) С кислотами-окислителями:
- При взаимодействии азотной кислоты любой концентрации и концентрированной серной с металлами водород никогда не выделяется!

- Zn + 2H2SO4(К) → ZnSO4 + SO2 + 2H2O
- 4Zn + 5H2SO4(К) → 4ZnSO4 + H2S + 4H2O
- 3Zn + 4H2SO4(К) → 3ZnSO4 + S + 4H2O
- 2H2SO4(к) + Сu → Сu SO4 + SO2 + 2H2O
- 10HNO3 + 4Mg → 4Mg(NO3)2 + NH4NO3 + 3H2O
- 4HNO3(к) + Сu → Сu (NO3)2 + 2NO2 + 2H2O
III. Взаимодействие металлов с водой
- 1) Активные (щелочные и щелочноземельные металлы) образуют растворимое основание (щелочь) и водород:
- 2Na + 2H2O → 2NaOH + H2
- Ca+ 2H2O → Ca(OH)2 + H2
- 2) Металлы средней активности окисляются водой при нагревании до оксида:
- Zn + H2O –t°→ ZnO + H2
- 3) Неактивные (Au, Ag, Pt) — не реагируют.
IV. Вытеснение более активными металлами менее активных металлов из растворов их солей:
- Cu + HgCl2 → Hg+ CuCl2
- Fe+ CuSO4 → Cu+ FeSO4
В промышленности часто используют не чистые металлы, а их смеси — сплавы, в которых полезные свойства одного металла дополняются полезными свойствами другого. Так, медь обладает невысокой твердостью и малопригодна для изготовления деталей машин, сплавы же меди с цинком (латунь) являются уже достаточно твердыми и широко используются в машиностроении. Алюминий обладает высокой пластичностью и достаточной легкостью (малой плотностью), но слишком мягок. На его основе готовят сплав с магнием, медью и марганцем — дуралюмин (дюраль), который, не теряя полезных свойств алюминия, приобретает высокую твердость и становится пригодным в авиастроении. Сплавы железа с углеродом (и добавками других металлов) — это широко известные чугун и сталь.
Металлы в свободном виде являются восстановителями. Однако реакционная способность некоторых металлов невелика из-за того, что они покрыты поверхностной оксидной пленкой, в разной степени устойчивой к действию таких химических реактивов, как вода, растворы кислот и щелочей.
Например, свинец всегда покрыт оксидной пленкой, для его перехода в раствор требуется не только воздействие реактива (например, разбавленной азотной кислоты), но и нагревание.
Оксидная пленка на алюминии препятствует его реакции с водой, но под действием кислот и щелочей разрушается.
Рыхлая оксидная пленка (ржавчина), образующаяся на поверхности железа во влажном воздухе, не мешает дальнейшему окислению железа.
Под действием концентрированных кислот на металлах образуется устойчивая оксидная пленка. Это явление называется пассивацией. Так, в концентрированной серной кислоте пассивируются (и после этого не реагируют с кислотой) такие металлы, как Ве, Вi, Со, Fе, Мg и Nb, а в концентрированной азотной кислоте — металлы А1, Ве, Вi, Со, Сг, Fе, Nb, Ni, РЬ, Тh и U.
При взаимодействии с окислителями в кислых растворах большинство металлов переходит в катионы, заряд которых определяется устойчивой степенью окисления данного элемента в соединениях (Nа+, Са2+,А13+,Fе2+ и Fе3+)
Восстановительная активность металлов в кислом растворе передается рядом напряжений. Большинство металлов переводится в раствор соляной и разбавленной серной кислотами, но Сu, Аg и Нg — только серной (концентрированной) и азотной кислотами, а Рt и Аи — «царской водкой».
Коррозия металлов
Нежелательным химическим свойством металлов является их коррозия, т. е. активное разрушение (окисление) при контакте с водой и под воздействием растворенного в ней кислорода (кислородная коррозия). Например, широко известна коррозия железных изделий в воде, в результате чего образуется ржавчина, и изделия рассыпаются в порошок.
Коррозия металлов протекает в воде также из-за присутствия растворенных газов СО2 и SО2; создается кислотная среда, и катионы Н+ вытесняются активными металлами в виде водорода Н2 (водородная коррозия).
Особенно коррозионно-опасным может быть место контакта двух разнородных металлов (контактная коррозия).
Между одним металлом, например Fе, и другим металлом, например Sn или Сu, помещенными в воду, возникает гальваническая пара.
Поток электронов идет от более активного металла, стоящего левее в ряду напряжений (Ре), к менее активному металлу (Sn, Сu), и более активный металл разрушается (корродирует).
Именно из-за этого ржавеет луженая поверхность консервных банок (железо, покрытое оловом) при хранении во влажной атмосфере и небрежном обращении с ними (железо быстро разрушается после появления хотя бы небольшой царапины, допускающей контакт железа с влагой). Напротив, оцинкованная поверхность железного ведра долго не ржавеет, поскольку даже при наличии царапин корродирует не железо, а цинк (более активный металл, чем железо).
Сопротивление коррозии для данного металла усиливается при его покрытии более активным металлом или при их сплавлении; так, покрытие железа хромом или изготовление сплава железа с хромом устраняет коррозию железа. Хромированное железо и сталь, содержащая хром (нержавеющая сталь), имеют высокую коррозионную стойкость.
Общие способы получения металлов в промышленности:
• электрометаллургия, т. е. получение металлов электролизом расплавов (для наиболее активных металлов) или растворов солей;
• пирометаллургия, т. е. восстановление металлов из руд при высокой температуре (например, получение железа в доменном процессе);
• гидрометаллургия, т. е. выделение металлов из растворов их солей более активными металлами (например, получение меди из раствора СuSO4 действием цинка, железа или алюминия).
В природе иногда встречаются самородные металлы (характерные примеры — Аg, Аu, Рt, Нg), но чаще металлы находятся в виде соединений (металлические руды). По распространенности в земной коре металлы различны: от наиболее распространенных — Аl, Nа, Са, Fе, Мg, К, Тi) до самых редких — Вi, In, Аg, Аu, Рt, Rе.
Источник: https://himege.ru/obshhaya-xarakteristika-metallov/
Металлы доклад по химии 9 класс сообщение
Металлы – химические элементы, которые имеют свойство высокой электропроводимости. Они широко распространены в морях, реках, горах, полях, в недрах земли и даже в телах живых организмов.
На сегодня, люди открыли 114 элементов, из которых 96 занимают металлы. Чтобы выяснить принадлежность вещества к металлам или неметаллам, нужно воспользоваться таблицей Менделеева. Нужно всего лишь провести диагональ с Астата к Бору. Все что находиться слева металлы. Все что справа неметаллы.
Они играют незаменимую роль в жизни. Они постоянно участвуют в процессах живых организмов. Именно поэтому отказаться от металлов нельзя.
Многие из металлов окисляются на свежем воздухе. Есть группа металлов, они называются благородные, воздух на них никак не влияет. В эту группу входят: золото, платина, серебро и многие другие. Некоторые со временем делают оксидную пленку и после этого реакция не продолжается.
Металлы можно поделить на 2 вида: цветные металлы и сплавы, черные металлы и его сплавы.
Первая группа, а именно золото, серебро, олово, медь, никель, называется так, потому что имеет разнообразный цвет. Его широко используют в ювелирных делах, для сознания украшений.
Черные элементы и сплавы. Сплавы получаются за счет легирования. Это добавление в металл другие элементы для придания новых свойств: прочность, гибкость, хрупкость, коррозионная устойчивость. Самым распространённым сплавом считается чугун и сталь.
Самой главным химическим свойством является, способность атомов отдавать электроны. Тем самым они становиться положительно заряженными ионами. Именно это изучал Бекетов. Он изобрел электрохимический ряд напряжений. Выглядит он так: Li, К, Ва, Na, Mg, Al, Mn, Zn, Cr, Fe, Co, Ni, Sn, Pb (H2) Bi, Cu, Hg, Ag, Pt, Au. Чем раньше стоит вещество, тем его активность сильнее.
Металлы используются в строительстве, потому как они прочны и не пропускают газы и жидкость. Также они являются хорошими проводниками. Этим активно пользуется человек. Их используют для электронагревательных элементов и резервистов как материал с сопротивлением. Еще из металлов и сплавов делают инструменты. В основном это сталь, алмаз, керамика.
Вариант 2
- Металлы, это обширная часть элементов или просто веществ, имеющих определенные характеристики — большой коэффициент электропроводности, достаточный запас пластичности и прочности, специфический цвет и большую степень ковки.
- Первыми металлами, известными людям с глубоко древности, стали золото и серебро, доступно встречающиеся на поверхности земли.
- В жизни металлы очень разнообразны, представлены в больших объемах и различных видах. Можно выделить несколько групп состояний металлов:
- Ag, Au, Rt, Cu – самородный вид.
- Fe3O4, Fe2O3, (NaK)2O×AlO3 — оксиды.
- KCl, BaSO4, Ca3(PO4)2),- соли.
- Cd – , Nb, Tl – сопутствующие минералы
Одними из часто находящихся на поверхности всей земли металлами являются алюминий и железо, а самыми редкими – калий и титан.
Можно выделить и рассмотреть основные свойства металлов:
- Температура плавления, у большинства веществ достаточна высокая, но есть металлы, которые легко плавятся даже на обычной газовой горелке, например олово.
- Такой показатель как плотность, позволяет разделить металлы на две категории: легкие, например литий, и тяжелые, например осмий или иридий. Это свойство позволяет применять металлы и их разнообразные сплавы для изготовления инструментов и станков, автомобилей и военной техники.
- Такое свойство как пластичность, позволяет использовать предметы из металлов в тех областях промышленности, где требуются особые гибкие и прочные на разрыв изделия.
- Электропроводность, обусловлена присутствием подвижных электронов в кристаллических решетках металлов. Медь и алюминий обычно используют при производстве проводниковой продукции, так как они имеют самую высокую электропроводность. Нихром, материал с повышенным сопротивлением, используют при производстве резисторов и в электронагревательных приборах.
- Высокая теплопроводность металлов, например натрия, позволяет использовать предметы из металла в устройствах, требующих быстрого охлаждения.
- Большинство металлов имеют примерно одинаковый светлый цвет — серого, голубого или желто-красного оттенка.
В современном мире все большее развитие приобретают изделия из металла, обработанного специальными методами, изготовленными по специальным технологиям с добавлением инновационных добавок. Свойства таких материалов улучшаются с каждым годом, хотя в этой области науки ученых ждет еще много открытий.

Источник: https://sochinite.ru/otvety/himiya/metally-doklad-9-klass-soobshchenie
Доклад на тему Металлы сообщение
В химии вещества делятся на две группы: неметаллы и металлы. Первая группа не так интересна, в отличие от другой. Сами металлы представляют собой группу простых веществ, обладающие металлическими свойствами.
Количество, виды и общая характеристика
В таблице Менделеева насчитывают около 98 металлов. К ним относятся такие элементы, как железо, алюминий, магний, золото, платина, вольфрам и много других. Входят в состав оксидов, солей, оснований и других соединений. Чаще всего металлы находят в виде руд.
Могут быть щелочные, щелочноземельные, переходные, лантаноиды, актиноиды и полуметаллы. Существует наука о переработке металлов – металлургия. На внешнем электронном слое от 1 до 3 электронов, поэтому металлы – восстановители.
Если глубоко смотреть в строение атомов металлов, то можно обнаружить кристаллическую решетку.
Физические свойства металлов
• Твердость. По сути, все металлы имеют твердую структуру, за исключением ртути, так как в обычном состоянии он жидкий. Самый мягкий металл — рубидий, а самый твердый – хром. • Плавкость. Все металлы плавятся, притом при разной температуре. Одни возможно растопить на плите, другие же приходится расплавлять в жаркой печи.
Самый легкоплавкий металл – ртуть. Кстати говоря, он плавится при температуре – 39 градусов. А самый тугоплавкий металл – вольфрам. • Плотность. Самый легкий – литий, его плотность равна 0, 53 г/см3. Самый тяжелый же металл пока неизвестен. Если точнее, то лидирующих элемента 2 – это осмий и иридий. Их плотности равны. • Пластичность.
Проще говоря, способность изгибать предмет в разные формы, то есть деформировать. Самым пластичным металлом считается золото. Из него удавалось сделать проволоку толщиной 0, 003 мм! • Электропроводность и теплопроводность. Все металлы достаточно хорошо проводят и тепло, и ток. А потому, 2 ряда проводников схожи друг с другом.
Лучшими являются серебро, медь и алюминий.
• Металлический блеск. Блеск – это явление отражения солнечных лучей от предмета. Металлы отлично блестят, но не в состоянии порошка. Исключение из данного правила составляют алюминий и магний. Самыми блестящими металлами считаются серебро, палладий и алюминий.
- Основные химические свойства металлов.
- • Реакции с кислородом (золото и платина не реагируют):
- 4 Al + 3 O2 = 2 Al2O3
- • Реакции с азотом (только активные металлы):
- 2 Al + N2 = 2 AlN
- • Реакции с серой (золото и платина – исключения):
- Fe + S = FeS
- • Реакции с водородом (только активные металлы):
- Mg + H2 = MgH2
- • Реакции с углеродом (только активные металлы):
- 2Na + 2C = Na2C2
Сообщение 2
В химии все вещества делятся на 2 вида: они либо металлы, либо неметаллы. У каждой группы свои свойства и строение. Металлов гораздо больше, чем неметаллов, и их функции имеют такую же важность. Так что же представляют собой металлы, какие свойства имеют и какую роль на нашей планете играют?
Краткие сведения о металлах.
Металлы – это химические элементы, обладающие определенными металлическими свойствами. Металлы находятся практически везде. От зданий, машин и мебели до шахт – металлы вокруг нас. Разве что в Антарктиде данных веществ не имеется, и то, может это под вопросом.
Металлы тоже делятся на группы. Например, существуют щелочные и щелочно-земельные металлы. Принято считать, что в периодической таблице Менделеева металлы размещены согласно диагонали, начинающаяся бором и заканчивающаяся астатом. На внешнем уровне от 1 до 3 электронов. У металлов сравнительно большой радиус атома.
Свойства металлов
Опять же, надо обратиться к таблице элементов. Зачем? А чтобы кое – что уточнить. В химии есть правило: металлические свойства уменьшаются по периоду (слева направо) и увеличиваются по группе (сверху вниз). А теперь к физическим свойствам. Их на самом деле много, но перечислить надо все.
Металлы – твердые вещества, если в нормальном состоянии, но ртуть – исключение, так как она жидкой формы. Отлично проводят электричество и тепло, а также блестят. Обладают пластичностью, а золото – лучший в этом плане.
Все металлы звенят. Цвет, как правило, либо серебристо – серый, либо серебристо – белый. Однако, то же золото ярко – желтого оттенка.
Имеют разную плотность, твердость (самый твердый – хром) и температуру плавления (самый тугоплавкий – вольфрам).
Кроме физических свойств есть же еще и химические. И вторых в разы больше, все точно не назвать. Но привести несколько примеров возможно. Из простых веществ металлы реагируют с водородом, кислородом, серой и галогенами. Теперь пара реакций со сложными веществами:
Металл реагирует с кислотой, если получится соль и металл находится в таблице электроотрицательности до водорода. Результатом будет соль и выделяющийся водород. У реакции 2 исключения – серная и азотная кислоты.
Активный металл вытеснит неактивный. Вот наглядное пособие: Fe + CuSO4 = FeSO4 + Cu. От лития до алюминия металлы брать нельзя, так как они – самые активные.

- Алмаз полезное ископаемое
Алмаз – это полезное природное ископаемое, которое находится глубоко в недрах земной коры, от всех камней он отличается особой прочностью. Цена данного ископаемого дорогостоящая, но на самом - Фет Афанасий
Поэзия Афанасия Фета была как бы ограждена от многих проблем социального и политического характера. Сам поэт был уверен, что всякое искусство должно служить исключительно красоте. - Созвездие Весы
Весы относится к созвездиям, которых легко различить на звёздном небе. Наилучшая пора для того, чтобы наблюдать его являются последние месяцы весны. Полностью весы можно увидеть в центральной - Вторая мировая война 1939-1945
Исторически сложилось, что Вторая Мировая война — одна из самых жестоких и кровопролитных войн в мире за последние 100 лет. Начало её датируется 1 сентября 1939 года, а конец 9 мая 1945 года. - Лесной пожар
Огонь – мощная сила природы. Она может приносить как пользу, так и вред. Ожидать пользу можно тогда, когда огонь полностью контролируется человеком и направляется на добро - Океаны
Мы нашу планету Земля называем голубой, потому что три четвертых ее поверхности занимает мировой океан и поэтому сверху из космоса она кажется голубого цвета.
Источник: https://doklad-i-referat.ru/soobshchenie/drugie/metally
Доклад-сообщение на тему Металлы 4, 7, 9 класс
На сегодняшний день благодаря открытиям многих ученых, нам известны многие химические элементы. Большую часть этих элементов составляют металлы. Их можно обнаружить в самых разных местах, и это не всегда недра земли. Металлы могут находиться в океанах, и даже реках.
То, что металлы сильно отличаются от неметаллов, определили еще Ломоносов. Он давно знал, что все металлы имеют твердую основу и отблеск. Сегодня почти все виды металлов люди научились применять в технике. Большой популярностью пользуется железо и его сплавы.
Многие металлические сплавы имеют хорошую прочность и устойчивость от коррозии.
Металл всегда обладал особенными металлическими свойствами. Самым распространенным металлом, который люди научились добывать из недр земли — является алюминий. Единственная отрасль, которая занимается добычей, и изготовлением продукции из металлов — называется металлургия. Почти все металлы, имеющиеся в природе, предстают перед человеком в виде соединений и руд.
Единственная задача правильно их обнаружить, достать и применить. Достаточно кропотливый процесс отделения и чистки, металлических руд, имеющихся в природе. А все это для получения потом, чистого металла. Любой металл в нормальных условиях, всегда будет твердым. Плавится, металлы начинают уже при достаточно высокой температуре. Все металлы различают по многим характеристикам.
Есть виды тяжелых металлов и легких.
Современное цивилизованное общество широко применяет металлы и их сплавы. Это связано с их высокой прочностью и непроницаемостью. Многие металлы люди научились использовать в виде проводников электричества. А другие применяют как состав резисторов во многих электронагревательных элементах. Металлы хорошо поддаются деформациям. При высокой температуре они гнутся и куются.
Это дает возможность изготовить из них проволоку и железные листы. Каждый день люди всего мира заняты добычей металла. Есть такие металлы, которые встречаются в природе в свободном состоянии. Весь процесс добычи таких металлов, заключается в разъединении основного металла от приставшей к нему породы.
Каждый добытый, и полученный металл, играет большую роль и пользу для многих отраслей.
Доклад Металлы сообщение
История человечества получила огромный толчок вперед, с тех времен, когда люди научились получать металлы. В связи с этим нам сегодня известны этапы развития промышленности и науки, новые эры человечества. Данные материалы и сегодня используются во всех отраслях жизнедеятельности человека.
Металлы имеют множество свойств, которые также люди постигали на протяжении истории. Основные свойства это прочность и пластичность, также ковкость. Металлы могут пропускать через себя тепло и электричество. Электропроводность зависит от температуры.
Основа металлов это состав атомов и кристаллическая решетка. Металлы устроены так, что электроны могут осуществлять движение по всему металлу. Далее люди выяснили, что металлы также могут сплавляться друг с другом.
В таком случае образуется сплав, основой которого являются несколько металлов.
Металлы можно разделить на два типа, которыми является черные металлы и цветные металлы. Сплавы из этих металлов можно получать благодаря тому, что каждый из этих типов имеет множество разнообразных и уникальных свойств. Также существуют металлиды и интерметаллиды. К черным металлам относятся сталь, чугун, а также другие элементы, имеющие в основе своего строения железо.
Цветные металлы включат в себя золото, платину, серебро. Также более редкие виды как титан и вольфрам. Более тяжелые как свинец, цинк и ртуть, а также легкие, как магний и алюминий.
Сплавы и металлы, отличимые друг от друга. Это заметно по внешним признакам, но и не только. Также их можно различить по физическим свойствам. К железным сплавам относят такие отличимые черты, как проводимость электричества и тепла, а также плавление при очень высокой температуре и намагничивание.
Как уже сказано выше, электропроводность зависит от температуры, когда она падает, то одни из видов металлов могут получить электропроводность гораздо выше, чем при высокой температуре. Также разные металлы по-своему реагируют на окружающую их среду.
То есть ржавчина по-разному может проявляться на разных видах металлов.
Что касается металлов относящихся к цветным, то их можно различать по прочности, твердости и пластичности.
Электро и теплопроводность, а также плотность являются составляющими, которые помогают различить металлы по физическим характеристикам. Широкое распространение имеют алюминий, титан, бронза и латунь.
Все эти металлы используются в производстве различных деталей и составляющих используемых в различных отраслях промышленности.
Если брать, в общем, то все металлы разделяют по их области применения и назначению. Существуют специально разработанные стандарты, которые называются ГОСТ. Перед тем как выбрать тот или иной металл, следует тщательно разобраться в стандартах, чтоб понимать правильность выбора.
4, 7, 9 класс, кратко по химии

Популярные темы сообщений
- Футбол
Футбол – это вид спорта, который предполагает в себе игру в мяч ногами, но, категорически нельзя руками. А целью игры является забить больше голов в ворота соперника, чем противник забьёт вам. Этот командный вид спорта считается самым популярным - Залив Охотского моря
Охотское море расположилось вблизи Японского и Берингова морей. Охотское море очень сильно входит в материк, в результате чего образуется залив. Между данным морем и тихим океаном находятся Курильские острова, - цветок Бегония
Мир цветущих растений был бы неполным без яркого, неприхотливого представителя семейства бегониевых – бегонии. Цветок пользуется спросом и в собственном доме, и на работе. Известным в свое время организатором экспедиции Мишель Бегоном
Источник: https://more-dokladov.ru/doklad-soobshchenie/geografiya/metallyi-4-7-9-klass
Металлы
К металлам относится большая часть элементов периодической системы – 82 химических элементов. Какими свойствами они обладают, и чем отличаются от неметаллов?

Металлами называют группу элементов, в виде простых веществ, которые обладают металлическими свойствами (пластичность, ковкость, блеск, электронная проводимость и т. д.)
Основное отличие элементов-металлов – они обладают только восстановительными свойствами, а в реакциях могут только окисляться. В соединениях они могут иметь только положительные степени окисления как в элементарных положительно заряженных ионах, так и в сложных ионах, где они образуют положительные центры.
Рис. 1. Список металлов.
Как правило, на внешнем уровне элементов металлов находится небольшое число электронов (1-3), значения электроотрицательности невысокие.
К металлам относятся все s-элементы (кроме водорода и гелия), d- и f-элементы, а также p-элементы под чертой бор-астат. Для типичных металлов характерен большой размер атомов, что способствует легкости отдачи валентных электронов.
Образующиеся положительные ионы устойчивы, так как имеют завершенную внешнюю электронную оболочку.
Все металлы, кроме ртути, при нормальных условиях в виде простых веществ находятся в твердом агрегатном состоянии и образуют металлическую кристаллическую решетку.
Рис. 2. Металлы в таблице Д.И. Менделеева.
В следующей таблицы представлены группы основных металлов:
| Группа металлов | Металл |
| Щелочные | литий, натрий, калий и т.д. |
| Щелочноземельные | кальций, стронций, барий и т.д. |
| Переходные | уран, титан, железо, платина и т.д. |
| постпереходные | алюминий, свинец, олово и т.д. |
| Тугоплавкие | молибден, вольфрам |
| Цветные | медь, титан, магний и т.д. |
| Благородные | золото, серебро и т.д. |
Металлы пластичны и ковки, особенно если на внешнем электронном уровне атомов по одному электрону: слои атомов перемещаются относительно друг друга без разрушения кристаллической решетки (щелочные металлы, медь, серебро, золото). В атомах непластичных хрупких металлов хрома и марганца – большое число валентных электронов.
Плотность, твердость, температура плавления металлов изменяются в широком диапазоне и зависят от атомной массы, строения атома и геометрии кристаллической решетки. Самый легкий металл – литий (плотность 0,53 г/см3), самый тяжелый – осмий (плотность 22,5 г/см3). Металлы с плотностью больше 5 г/см3 относят к тяжелым, меньше 5 г/см3 – к легким металлам.
Самая низкая температура плавления у ртути (-39 градусов по Цельсию), самый тугоплавкий металл – вольфрам (температура плавления 3410 градусов по Цельсию.) Энергия атомизации вольфрама составляет 836 кДж/моль, а температура кипения его 5930 градусов.
Металлы вступают в реакцию как с простыми, так и со сложными веществами. Как типичные восстановители металлы реагируют почти со всеми неметаллами-окислителями (кислород, сера, азот и т. д.):
Также металлы реагируют с такими сложными веществами, как оксиды и гидроксиды, разбавленные растворы кислот, с растворенными в воде щелочами.
В пределах одного и того же периода металлические свойства ослабевают, а неметаллические усиливаются; в пределах одной и той же группы (в главной подгруппе) металлические свойства усиливаются, а неметаллические ослабевают
Рис. 3. Металлы главных подгрупп.
Самый распространенный на земле элемент-металл – алюминий. За ним следуют железо, кальций, натрий.
Некоторые металлы встречаются в природе в самородном состоянии (золото, ртуть, платина), но в основном они находятся в природе в виде оксидов и солей.
Получение металлов происходит с помощью металлургии (получение из руд), пирометаллургии (получение с помощью реакции восстановления при высокой температуре), гидрометаллургии (извлечение из руд в виде растворимых соединений), электрометаллургии (получение металлов электролизом расплавов и растворов их соединений).
Металлы – вещества, которые обладают высокой электро- и теплопроводностью, ковкостью, пластичностью и металлическим блеском. В данной статье по химии 9 класса рассматриваются их физические и химические свойства, формулы класса металлов, а также способы получения.
Средняя оценка: 4. Всего получено оценок: 442.
Источник: https://obrazovaka.ru/himiya/metally-formula-9-klass.html