Почти все металлы и сплавы постепенно разрушаются под воздействием факторов окружающей среды. При взаимодействии металлов с веществами воздуха и атмосферными осадками на их поверхности образуется плёнка, состоящая из оксидов, сульфидов, карбонатов и других соединений.
Эти соединения обладают совершенно иными свойствами, чем сами металлы. В обычной жизни мы часто употребляем слова «ржавчина», «ржавление», видя коричнево-рыжий налёт на изделиях из железа и его сплавов. Ржавление — это коррозия железа.
Коррозия — это процесс самопроизвольного разрушения металлов и их сплавов под влиянием внешней среды (от лат. corrosio — «разъедание»).
 |
 |
 |
Коррозия изделий из сплавов железа. Бурый налёт — ржавчина — состоит из гидроксида и оксида железа((III))
 |
 |
 |
Предметы из меди и её сплавов (предметы искусства, памятники, крыши зданий) со временем подвергаются коррозии. Патина — налёт зелёного цвета — состоит в основном из гидроксокарбоната меди((II))
В результате коррозии ухудшаются многие свойства изделий: уменьшаются их прочность, пластичность, блеск, снижается электропроводность и т. д.
Коррозия металлов наносит большой вред народному хозяйству:
- возникают огромные материальные потери из-за разрушения нефтепроводов, газопроводов, водопроводов, деталей сельскохозяйственной техники, автомобилей, судов, мостов, оборудования, используемого в различных производствах;
- уменьшается надежность металлоконструкций;
- простаивает производство из-за необходимости замены вышедшего из строя оборудования;
- происходят потери сырья и продукции в результате разрушения газо-, нефте- и водопроводов;
- наносится ущерб природе и здоровью человека; в результате утечек нефтепродуктов и других веществ загрязняется окружающая среда;
- загрязняется продукция, а следовательно, снижается её качество.
Способы защиты от коррозии
1. Нанесение защитных покрытий.
- Металлическое изделие покрывают другими металлами (никелирование, хромирование, цинкование, лужение — покрытие оловом).
 |
 |
 |
| Никелированная труба | Хромированный кран | Консервные банки, изготовленные из лужёной жести |
- Металлические изделия покрывают лаками, красками, эмалями, маслами, полимерами.
 |
||
| Нанесение защитного покрытия на поверхность металла | Эмалированная стальная кастрюля | Металлочерепица изготавливается из жести, покрытой полимером |
2. Применение сплавов, стойких к коррозии.
Детали машин, аппаратов, инструменты и предметы быта изготовляют из нержавеющей стали, содержащей специальные легирующие (замедляющие коррозию) добавки: хром, никель и другие металлы.
Изделия из нержавеющей стали
3. Протекторная защита.
К защищаемой металлической конструкции присоединяют кусок более активного металла (протектор), который разрушается, защищая основной металл. В качестве протектора при защите корпусов судов, трубопроводов, кабелей используют магний, алюминий, цинк.
4. Изменение состава среды.
Для того чтобы предотвратить потери из-за коррозии, проводится специальная обработка электролита или той среды, в которой находится защищаемая металлическая конструкция. Практикуется также введение ингибитора — вещества, замедляющего коррозию.
Например, при подготовке воды, поступающей в котельные установки, проводят удаление растворённого в воде кислорода (деаэрацию).
Источник: https://www.yaklass.ru/p/himija/89-klass/klassy-neorganicheskikh-veshchestv-14371/metally-15154/re-3801c99f-317b-4cc9-a916-0bb75ff5906a
Коррозия металлов — доклад сообщение 9 класс по химии
В природе рано или поздно все ломается, разрушается, приходит в негодность. Деревья и растения засыхают, цветы вянут, а люди умирают от различных причин. Даже неживым предметам грозит такой конец.
Металлы, из которых создается разного рода техника, являются хорошим примером. Причин разрушения металлов достаточно: прогиб, трещины, износ или пластическая деформация. Но самая распространенная причина – это коррозия.
Как она возникает? Чем грозит для людей? И приносит ли коррозия хоть какую-нибудь пользу?
Коррозия – это приход материала в негодность из-за разных воздействий окружающей среды на него. Синонимом слову коррозия является другое слово – ржавчина. Наиболее хорошо данный процесс можно увидеть на примере коррозии железа в водной среде с участием кислорода:
4Fe + 6H2O + 3O2 = 4Fe(OH)3
Тут стоит обратить внимание на химическое соединение Fe(OH)3 – гидроксид железа. Это основание и есть та ржавчина, которую люди видят повседневно. К неметаллам понятие коррозии не относится, в большинстве случаев. Температура влияет на то, насколько быстро или медленно протекает процесс коррозии.
Главные виды коррозий и их отличия.
Всего отмечают 4 типа коррозий. Они все относятся к металлам, как правило.
1) Электрохимическая.
Короче говоря, это коррозия, происходящая под действием на определенный металл или изделие из соответствующего элемента электролита. Например, капля воды. Если поместить металл в водную среду и там будет присутствовать какая – либо соль, то процесс будет проходить быстрее.
- 2) Водородная.
- Такая коррозия случается тогда, когда при реакции с металлом восстанавливается вода или гидроксоний (H3O). Наглядно рассмотреть процесс данного вида коррозии можно на следующей реакции:
- 2H3O+ + 2e- = 2H2O + H2
- 3) Кислородная.
- Эта коррозия похожа на прошлую, только в данном случае выделяться будет кислород:
- O2 + 2H2O + 4e- = 4OH-
Стоит уточнить один момент. Все виды, рассмотренные ранее, относятся к тем ситуациям, когда друг с другом действуют 2 металла. Еще есть случай с одним металлом, когда поверхность вещества неоднородна. Это химическая коррозия.
Доклад 2
Под воздействием атмосферных или иных условий эксплуатации металлические поверхности покрываются рыжей, рыхлой пленкой, которая называется ржавчиной или коррозией. Учеными установлено, что на производстве 10% всех металлических изделий становится непригодными.
Происходит процесс разрушения конструкции, качество ухудшается, и они приходят в негодность.
Коррозийный процесс зависит от таких факторов как:
- вида среды;
- условий и механизма протекания;
- температуры;
- других.
Коррозийный процесс различают:
- по характеру разрушения;
- по условиям протекания.
Химическая и электрохимическая коррозии
Химическая коррозия возникает в результате взаимодействия кислорода с металлом и встречается часто. В этом процессе могут участвовать вода, соль, кислота, щелочь, растворы солей. Они образуют окись железа, что приводит к появлению ржавчины. Различают два вида химической коррозии:
Электрохимическая коррозия
В среде электролитов атом выпадает из кристаллической решетки и происходит анодная и катодная реакция. Ионы металла (электроны) проникают в раствор и далее соединяются с окислителем. Этот процесс называется деполяризацией.
Электрохимическая коррозия существуют в двух разновидностях:
- в электролитах;
- атмосферная коррозия.
Металлические поверхности, контактируя с воздухом, в некоторых местах поверхности могут быть анодом, другие катодом. Такую коррозию называют:
- аэрационная;
- морская;
- биологическая;
- другие.
Методы защиты от коррозии
Ущерб от коррозии ежегодно исчисляется миллиардными убытками. И способы защиты покрытий являются основой для защиты металлических конструкций от коррозии.
Защитные покрытия подразделяются:
- анодное или катодное;
- лаком, битумом, красками;
- химическими составами;
- протекторная защита.
Самой популярной в настоящее время является лакокрасочная защита металлических конструкций. Стоит недорого, защищает поверхность в течение 7- 8 лет, а другие средства защиты металлических конструкций от коррозии являются более затратными.
Загрязнение атмосферы влияет на процессы коррозии металлов и исключить
это разрушение невозможно. Можно только замедлить коррозийный процесс, применяя различные методы защиты.

Источник: https://sochinite.ru/otvety/himiya/korroziya-metallov-9-klass
Доклад на тему Коррозия металлов 9 класс
Коррозия (от лат. сorrodere – разрушать, разъедать, corrosion — разъедание) – реакция, выражающаяся в разрушении материалов, вызываемая воздействием окружающей среды. Для металлов чаще всего в повседневной жизни используется термин «ржавление».
Очень важным фактором, влияющим на скорость коррозии, является температура. То есть, чем она выше – тем быстрее происходит химическая реакция.
Термин «коррозия» относится как к металлам, так и к неметаллическим веществам. Применительно ко вторым, это определение означает потерю возможности эксплуатации и разрушение.
Существует несколько типов коррозии:
- Электрохимическая. Происходит под воздействием гальванических элементов, которые возникают в среде.
- Водородная. Коррозия с водной деполяризацией.
- Кислородная. Происходит при отсутствии выделения водорода – начинает восстанавливаться кислород.
- Химическая. Взаимодействие металла с агрессивной средой, которое не сопровождается появлением электрохимических процессов на границе фаз.
По типу производимых разрушений коррозия подразделяется на местную и сплошную. Вторая, в свою очередь, подразделяется на равномерную и сплошную.
Что такое коррозионная среда?
Коррозионная (или агрессивная) среда – это та среда, в которой материал подвергается реакции коррозии.
Классификация сред по их взаимодействию с металлами:
- Неагрессивные
- Слабоагрессивные
- Среднеагрессивные
- Сильноагрессивные
Как происходит борьба с коррозией?
Как правило, выделяются три направления, включающие в себя методы борьбы с коррозией:
- Конструкционный
- Активный
- Пассивный
Они включают в себя использование нержавеющей стали, цветных металлов, кортеновских сталей. Также практикуется нанесение на металл определённого защитного покрытия, препятствующего возникновению коррозии.
Влияние на экономику
Что касается, влияния коррозионных процессов на экономику, то убытки от неё исчисляются огромными суммами – миллиардами долларов.
Одной из самых частых причин разрушения и прихода в непригодное для использования состояние различных металлических конструкций, в частности мостов, является ржавчина. Истории известны несколько случаев внезапного обрушения мостов по причине пагубного влияния коррозии на материалы, использованные при строительстве. Количество жертв в таких катастрофах, как правило, весьма велико.
Вариант №2
Как известно металлы не встречаются в природе в чистом виде. Лишь в виде руд или химических соединений. Коррозия является распадом металла на близкиех к руде химическим соединениям.
Защита от коррозии является затратным предприятием. Ни один металл не защищен от коррозии. Некоторые поддаются ее воздействию быстрее, другие медленнее. Чаще всего коррозия начинается с внешних слоев, проникая все глубже.
Различают такие виды коррозии:
- Химическая. Это воздействие газов на металл. Например, аргентум сульфид оседает пленкой на поверхности серебра при взаимодействии последнего с соединениями серы. Эффективнее всего против химической коррозии помогает воронение.
Во время воронения металл подвергается воздействию высоких температур, в следствии чего возникает оксидная пленка, которая и предотвращает развитие коррозии.
- Электрохимическая. Возникает чаще всего на поверхности сплавов. На металлах образуются гальванические структуры, а вода выступает проводником.
Возникновению коррозии также способствуют перепады температуры, загрязнение воздуха химически активными соединениями, что особенно вероятно в местах скоплений промышленных объектов.
Механические нагрузки также способствуют возникновению коррозии. Возникают трещины, которые уходят глубоко внутрь металла, подрывая его прочность.
Еще одним способом защиты от коррозии является покрытие металла лаком или краской, но это весьма недолговечная защита, так как краска постепенно разрушается. Более надежным способ является металлизация, то есть погружение изделия в расплавленный металл, в следствие чего возникает пленка, которая и защищает металл.
Коррозия несет огромные убытки, но способы изложенные выше смогут защитить металлы от ее пагубного влияния.
9 класс

Популярные темы сообщений
- Головоногие моллюски
Головоногие моллюски получили свое название из-за щупалец («ног»), которые растут практически из головы. Их может быть 8, 10 и даже больше. У подкласса двужаберных моллюсков нет раковины, к ним относят каракатиц, кальмаров, а также осьминогов. - Великая Отечественная Война
22-го июня 1941 года началась, сама жестокая и великая война. В этой войне на защиту страны встал весь народ. Простые люди, старики, женщины, дети. И не всем им удалось вернуться домой. - Швеция
Самая большая скандинавская страна — это Швеция. Она находится на Скандинавском полуострове и на островах, которые расположены вблизи. Соседями Швеции являются Дания, Норвегия и Финляндия. Официально страну называют Королевство Швеция.
Источник: https://more-dokladov.ru/doklad-soobshchenie/raznoe/korroziya-metollov-9-klass
Коррозия металла
Процесс самопроизвольного разрушения металлов и их сплавов называется коррозией металлов. Коррозия возникает при контакте с веществами окружающей среды. Латинское слово corrosio означает «разъедать».

Коррозия – результат взаимодействия металла с веществами-окислителями, к которым относятся кислород, водород, кислоты, щёлочи. Основной характеристикой коррозии является окислительно-восстановительная реакция. Металл при коррозии окисляется, восстанавливая окислительный компонент среды.
Рис. 1. Коррозия.
Условиями для образования коррозии являются:
- наличие металла – простого или сложного вещества (сплава);
- наличие коррозионной среды – активных веществ, находящихся вокруг металла и воздействующих на его поверхность;
- продолжительный период времени.
Ржавчина – оксид или гидроксид железа (III) – образуется на железосодержащих изделиях и имеет рыжий цвет. Предметы из меди при коррозии приобретают зеленоватый оттенок. Это многослойная патина, верхний слой которой состоит из карбоната меди (II).
Рис. 2. Патина.
Коррозия классифицируется по нескольким признакам. Классификация приведена в таблице.
| Признак | Вид | Описание |
| Участки поражения | Равномерная | Захватывает всю металлическую поверхность |
| Язвенная (местная) | Охватывает часть поверхности | |
| Точечная (питтинг) | Глубоко поражает отдельные участки | |
| Механизм протекания | Химическая | Протекает под действием химических веществ в отсутствии электролитов. Может происходить на воздухе (газовая коррозия) и в водной среде (жидкостная коррозия). Под действием коррозионной среды металл окисляется, на поверхности образуются сульфидные, оксидные и другие плёнки, а коррозионные вещества восстанавливаются. Выделяют кислородную химическую коррозию и водородную деполяризацию |
| Электрохимическая | Протекает в присутствии электролита – проводящего ток вещества в растворах или в расплавах. Может происходить в грунте, море, атмосфере. Состоит из анодного и катодного процессов, взаимосвязанных между собой и протекающих одновременно. При анодном процессе металл окисляется, при катодном происходит восстановление окислителя, находящегося в растворе (расплаве) | |
| Тип агрессивной среды | Атмосферная | Происходит во влажной атмосфере |
| Газовая | Протекает в отсутствии влаги | |
| Грунтовая | Происходит в кислых и щелочных почвах | |
| Жидкостная | Протекает в жидкой среде | |
| Радиационная | Воздействие радиоактивных веществ | |
| Контактная | Соприкосновение двух металлов во влажной среде | |
| Биокоррозия | Влияние живых организмов. Продукты жизнедеятельности бактерий окисляют и разрушают металл |
Если в металле находятся примеси (соли, неметаллы, модификации углерода), то наблюдается ускоренная коррозия. Проверить это можно дома, опустив в соляной раствор (NaCl + H2O) металлическую деталь. Уже через сутки появится ржавчина.
При постоянном взаимодействии с химическими элементами окружающей среды металл со временем истончается, становится хрупким, шершавым. Такой металл нельзя использовать в производстве. Поэтому были разработаны способы защиты металла от коррозии.
Сохранить металлические свойства и продлить срок службы металлическим изделиям можно с помощью:
- металлического покрытия – нанесения тонким слоем других металлов;
- неметаллического покрытия – изоляции металла от окружающей среды органическими или неорганическими веществами – лаками, эмалью, пластмассой, резиной, красками;
- электрохимической защиты – наложения постоянного электрического поля;
- ингибиторной защитой – нанесения ингибиторов для защиты металла в кислой среде.
Металлическое покрытие бывает двух видов:
- катодное – покрытие пассивными металлами (Ni, Sn, Ag, Au);
- анодное – покрытие активными металлами (Zn, Cr).
Рис. 3. Оцинкованное железо.
Морские суда защищают пластинами, сделанными из более активных металлов (алюминия, магния, цинка), чем корпус корабля.
Металл также защищают «изнутри», добавляя в состав коррозиестойкие химические элементы. Например, нержавеющая сталь содержит хром, углерод, кремний, серу, фосфор, марганец.
Из урока химии 9 класса узнали о коррозии, её видах и способах защиты. Коррозия – саморазрушение металла под воздействием факторов окружающей среды, к которым относится воздействие кислорода, водорода, кислот, щелочей.
Под действием внешних элементов поверхность металла окисляется, становится тонкой и хрупкой. Тема коррозии важна для производства сплавов и металлических изделий.
Чтобы продлить срок службы, в металл добавляют устойчивые к коррозии элементы или покрывают поверхность другими металлами, органическими или неорганическими веществами, ингибиторами.
Средняя оценка: 4.6. Всего получено оценок: 139.
Источник: https://obrazovaka.ru/himiya/korroziya-metalla-9-klass.html
Доклад-сообщение Коррозия металлов
Со времени своего появления человек активно изучал то место, в котором оно обитал, что и привело его к прогрессу, и началу жизни на вершине всего животного мира, таким образом, а именно с помощью разума и познания, наш вид стал главенствующим видом на всей территории планеты земля.
Изучая планету, человек также находил огромное множество полезных ископаемых, которые так или иначе были ему нужны для дальнейшего развития, и самыми важными из низ были металлы. Металлы – именно те полезные ископаемые, которые позволили человеку достичь того уровня технологического прогресса, который мы имеем сейчас.
Хоть металлы и очень прочные, однако, они также обладают своим рядом уязвимостей и недостатков.
В первую очередь металлы, конечно же, не вечны, как и всё в этом мире, а потому нельзя быть в точности уверенным в том, что тот или иной металл выдержит проверку определённым количеством времени, и сможет пройти через все невзгоды, которые ему принесёт это самое время.
И самой большой опасностью для металлов, которые подвержены ей, является коррозия. Коррозия, или попросту ржавчина – химический состав, который образуется на металле под влиянием химических реакций.
Обычно коррозия не сулит металлу ничего хорошего, так как она, по сути, заменяет молекулы металлы на свои, которые намного более хрупки, чем те же молекулы металла.
Однако коррозия далеко не во всех случаях плохое явление. Очень часто реакция коррозия используется учёными в целях проведения экспериментов и исследований, что соответственно помогает науке.
Так или иначе, в нашем мире просто не может быть чего-то однозначного, и всегда в чём-то плохом найдётся толика хорошего, как и в огромном количестве хорошего всегда найдётся своя ложка дёгтя. Однако это мы уже отходим от темы.
Люди использовали самые разные способы избавления от коррозии, самым первым из которых стало простое отбивание коррозии об какой-либо твёрдый предмет, твёрдость которого превышает твёрдость металла. Такой способ применялся людьми очень и очень давно.
В настоящее же время человек придумал множество различных способов, с помощью которых можно реабилитировать металл, придав ему, таким образом, новую жизнь, и способы эти обязаны своим возникновением исследованиям коррозийнойности металлов.
Потому мы видим, что коррозия очень важный дефект металла, который хоть и плохо на него влияет, но также и оказывает положительное воздействие.
9 класс по химии.

- Архитектура Санкт-Петербурга
С момента строительства Санкт-Петербурга прошло достаточно времени, за это время город обрел свой исторический облик, который стал его визитной карточкой и привлекает множество туристов на пр - Закаливание организма
В большинстве случаев люди думают, что закаливание — обливание и купание в холодной воде, отчасти это правда. На самом деле закаливание организма — это влияние на организм самой природой и ра - Искусство эпохи Возрождения
В XIV-XIV веке на западе появилось новое направление в искусстве, получившее название Возрождения или Ренессанс. Это понятие ввел в оборот Д. Вазари, по его мнению, в этот период возродился - Морошка
та ягода, произрастающая в лесах Сибири, известна своими целебными свойствами и необычным вкусом. Она относится к травянистым растениям из семейства малины. Ее можно встретить в заболоченных - Традиции нашей семьи
Традиции возникают со временем и объединяют всех членов семьи. Общие традиции — это увлекательные, веселые и забавные мероприятия, которые переходят из года в год. У каждой семьи свои традици - Полимеры
Вещества, которые имеют цепочки с множеством звеньев, называют полимерами. Полимеры бывают органические и неорганические, а также кристаллические и аморфные.
Источник: https://doklad-i-referat.ru/soobshchenie/drugie/korroziya-metallov
Коррозия металлов. Виды коррозии металлов
Материалы из металлов под химическим или электрохимическим воздействием окружающей среды подвергаются разрушению, которое называется коррозией. Коррозия металлов вызывается окислительно-восстановительными реакциями, в результате которых металлы переходят в окисленную форму и теряют свои свойства, что приводит в негодность металлические материалы.
Можно выделить 3 признака, характеризующих коррозию:
- Коррозия – это с химической точки зрения процесс окислительно-восстановительный.
- Коррозия – это самопроизвольный процесс, возникающий по причине неустойчивости термодинамической системы металл – компоненты окружающей среды.
- Коррозия – это процесс, который развивается в основном на поверхности металла. Однако, не исключено, что коррозия может проникнуть и вглубь металла.
Виды коррозии металлов
Наиболее часто встречаются следующие виды коррозии металлов:
- Равномерная – охватывает всю поверхность равномерно
- Неравномерная
- Избирательная
- Местная пятнами – корродируют отдельные участки поверхности
- Язвенная (или питтинг)
- Точечная
- Межкристаллитная – распространяется вдоль границ кристалла металла
- Растрескивающая
- Подповерхностная
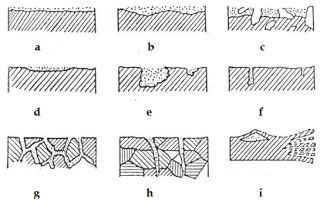
 Основные виды коррозии
Основные виды коррозии
С точки зрения механизма коррозионного процесса можно выделить два основных типа коррозии: химическую и электрохимическую.
Химическая коррозия металлов
Химическая коррозия металлов — это результат протекания таких химических реакций, в которых после разрушения металлической связи, атомы металла и атомы, входящие в состав окислителей, образуют химическую связь. Электрический ток между отдельными участками поверхности металла в этом случае не возникает. Такой тип коррозии присущ средам, которые не способны проводить электрический ток – это газы, жидкие неэлектролиты.
Химическая коррозия металлов бывает газовой и жидкостной.
Газовая коррозия металлов – это результат действия агрессивных газовых или паровых сред на металл при высоких температурах, при отсутствии конденсации влаги на поверхности металла.
Это, например, кислород, диоксид серы, сероводород, пары воды, галогены.
Такая коррозия в одних случаях может привести к полному разрушению металла (если металл активный), а в других случаях на его поверхности может образоваться защитная пленка (например, алюминий, хром, цирконий).
Жидкостная коррозия металлов– может протекать в таких неэлектролитах, как нефть, смазочные масла, керосин и др. Этот тип коррозии при наличии даже небольшого количества влаги, может легко приобрести электрохимический характер.
При химической коррозии скорость разрушения металла пропорциональна скорости химической реакции и той скорости с которой окислитель проникает сквозь пленку оксида металла, покрывающую его поверхность. Оксидные пленки металлов могут проявлять или не проявлять защитные свойства, что определяется сплошностью.
- Сплошность такой пленки оценивают величине фактора Пиллинга—Бэдвордса: (α = Vок/VМе) по отношению объема образовавшегося оксида или другого какого-либо соединения к объему израсходованного на образование этого оксида металла
- α = Vок/VМе = Мок·ρМе/(n·AMe·ρок),
- где Vок — объем образовавшегося оксида
- VМе — объем металла, израсходованный на образование оксида
- Мок – молярная масса образовавшегося оксида
- ρМе – плотность металла
- n – число атомов металла
- AMe — атомная масса металла
- ρок — плотность образовавшегося оксида
Оксидные пленки, у которых α < 1, не являются сплошными и сквозь них кислород легко проникает к поверхности металла. Такие пленки не защищают металл от коррозии. Они образуются при окислении кислородом щелочных и щелочно-земельных металлов (исключая бериллий).
- Оксидные пленки, у которых 1 < α < 2,5 являются сплошными и способны защитить металл от коррозии.
- При значениях α > 2,5 условие сплошности уже не соблюдается, вследствие чего такие пленки не защищают металл от разрушения.
- Ниже представлены значения α для некоторых оксидов металлов
| металл | оксид | α | металл | оксид | α |
| K | K2O | 0,45 | Zn | ZnO | 1,55 |
| Na | Na2O | 0,55 | Ag | Ag2O | 1,58 |
| Li | Li2O | 0,59 | Zr | ZrO2 | 1.60 |
| Ca | CaO | 0,63 | Ni | NiO | 1,65 |
| Sr | SrO | 0,66 | Be | BeO | 1,67 |
| Ba | BaO | 0,73 | Cu | Cu2O | 1,67 |
| Mg | MgO | 0,79 | Cu | CuO | 1,74 |
| Pb | PbO | 1,15 | Ti | Ti2O3 | 1,76 |
| Cd | CdO | 1,21 | Cr | Cr2O3 | 2,07 |
| Al | Al2O2 | 1,28 | Fe | Fe2O3 | 2,14 |
| Sn | SnO2 | 1,33 | W | WO3 | 3,35 |
| Ni | NiO | 1,52 |
Электрохимическая коррозия металлов
Электрохимическая коррозия металлов – это процесс разрушения металлов в среде различных электролитов, который сопровождается возникновением внутри системы электрического тока.
При таком типе коррозии атом удаляется из кристаллической решетки результате двух сопряженных процессов:
- Анодного – металл в виде ионов переходит в раствор.
- Катодного – образовавшиеся при анодном процессе электроны, связываются деполяризатором (вещество — окислитель).
- Сам процесс отвода электронов с катодных участков называется деполяризацией, а вещества способствующие отводу – деполяризаторами.
- Наибольшее распространение имеет коррозия металлов с водородной и кислородной деполяризацией.
- Водородная деполяризация осуществляется на катоде при электрохимической коррозии в кислой среде
- 2H++2e— = H2 разряд водородных ионов
- 2H3O++2e— = H2 + 2H2O
- Кислородная деполяризация осуществляется на катоде при электрохимической коррозии в нейтральной среде
- O2 + 4H++4e— = H2O восстановление растворенного кислорода
- O2 + 2H2O + 4e— = 4OH—
- Все металлы, по их отношению к электрохимической коррозии, можно разбить на 4 группы, которые определяются величинами их стандартных электродных потенциалов:
- Активные металлы (высокая термодинамическая нестабильность) – это все металлы, находящиеся в интервале щелочные металлы — кадмий (Е0 = -0,4 В). Их коррозия возможна даже в нейтральных водных средах, в которых отсутствуют кислород или другие окислители.
- Металлы средней активности (термодинамическая нестабильность) – располагаются между кадмием и водородом (Е0 = 0,0 В). В нейтральных средах, в отсутствии кислорода, не корродируют, но подвергаются коррозии в кислых средах.
- Малоактивные металлы (промежуточная термодинамическая стабильность) – находятся между водородом и родием (Е0 = +0,8 В). Они устойчивы к коррозии в нейтральных и кислых средах, в которых отсутствует кислород или другие окислители.
- Благородные металлы (высокая термодинамическая стабильность) – золото, платина, иридий, палладий. Могут подвергаться коррозии лишь в кислых средах при наличии в них сильных окислителей.
Электрохимическая коррозия может протекать в различных средах. В зависимости от характера среды выделяют следующие виды электрохимической коррозии:
- Коррозия в растворах электролитов — в растворах кислот, оснований, солей, в природной воде.
- Атмосферная коррозия – в атмосферных условиях и в среде любого влажного газа. Это самый распространенный вид коррозии.
- Например, при взаимодействии железа с компонентами окружающей среды, некоторые его участки служат анодом, где происходит окисление железа, а другие – катодом, где происходит восстановление кислорода:
- А: Fe – 2e— = Fe2+
- K: O2 + 4H+ + 4e— = 2H2O
- Катодом является та поверхность, где больше приток кислорода.
- Почвенная коррозия – в зависимости от состава почв, а также ее аэрации, коррозия может протекать более или менее интенсивно. Кислые почвы наиболее агрессивны, а песчаные – наименее.
- Аэрационная коррозия — возникает при неравномерном доступе воздуха к различным частям материала.
- Морская коррозия – протекает в морской воде, в связи с наличием в ней растворенных солей, газов и органических веществ.
- Биокоррозия – возникает в результате жизнедеятельности бактерий и других организмов, вырабатывающих такие газы как CO2, H2S и др., способствующие коррозии металла.
- Электрокоррозия – происходит под действием блуждающих токов на подземных сооружениях, в результате работ электрических железных дорог, трамвайных линий и других агрегатов.
Методы защиты от коррозии металла
Основной способ защиты от коррозии металла – это создание защитных покрытий – металлических, неметаллических или химических.
Металлические покрытия.
Металлическое покрытие наносится на металл, который нужно защитить от коррозии, слоем другого металла, устойчивого к коррозии в тех же условиях.
Если металлическое покрытие изготовлено из металла с более отрицательным потенциалом (более активный) , чем защищаемый, то оно называется анодным покрытием.
Если металлическое покрытие изготовлено из металла с более положительным потенциалом (менее активный), чем защищаемый, то оно называется катодным покрытием.
Например, при нанесении слоя цинка на железо, при нарушении целостности покрытия, цинк выступает в качестве анода и будет разрушаться, а железо защищено до тех пор, пока не израсходуется весь цинк. Цинковое покрытие является в данном случае анодным.
Катодным покрытием для защиты железа, может, например, быть медь или никель. При нарушении целостности такого покрытия, разрушается защищаемый металл.
- Неметаллические покрытия.
- Такие покрытия могут быть неорганические (цементный раствор, стекловидная масса) и органические (высокомолекулярные соединения, лаки, краски, битум).
- Химические покрытия.
- В этом случае защищаемый металл подвергают химической обработке с целью образования на поверхности пленки его соединения, устойчивой к коррозии. Сюда относятся:
- оксидирование – получение устойчивых оксидных пленок (Al2O3, ZnO и др.);
- фосфатирование – получение защитной пленки фосфатов (Fe3(PO4)2, Mn3(PO4)2);
- азотирование – поверхность металла (стали) насыщают азотом;
- воронение стали – поверхность металла взаимодействует с органическими веществами;
- цементация – получение на поверхности металла его соединения с углеродом.
Изменение состава технического металла также способствует повышению стойкости металла к коррозии. В этом случае в металл вводят такие соединения, которые увеличивают его коррозионную стойкость.
Изменение состава коррозионной среды (введение ингибиторов коррозии или удаление примесей из окружающей среды) тоже является средством защиты металла от коррозии.
Электрохимическая защита основывается на присоединении защищаемого сооружения катоду внешнего источника постоянного тока, в результате чего оно становится катодом. Анодом служит металлический лом, который разрушаясь, защищает сооружение от коррозии.
Протекторная защита – один из видов электрохимической защиты – заключается в следующем.
К защищаемому сооружению присоединяют пластины более активного металла, который называется протектором. Протектор – металл с более отрицательным потенциалом – является анодом, а защищаемое сооружение – катодом. Соединение протектора и защищаемого сооружения проводником тока, приводит к разрушению протектора.
Источник: https://zadachi-po-khimii.ru/obshaya-himiya/korroziya-metallov.html
Коррозия металлов
- Министерство образования Российской Федерации
- Тихоокеанский Государственный Экономический Университет
- РЕФЕРАТ
- Дисциплина :Химия
- Тема: Коррозия металлов
- Выполнил:
- Студентка 69группы
- Кривицкая Евгения
- Находка
- 2010г.
Коррозия неметаллических материалов
По мере ужесточения условий эксплуатации (повышение температуры, механических напряжений, агрессивности среды и др.) и неметаллические материалы подвержены действию среды.
В связи с чем термин «коррозия» стал применяться и по отношению к этим материалам, например «коррозия бетонов и железобетонов», «коррозия пластмасс и резин».
При этом имеется в виду их разрушение и потеря эксплуатационных свойств в результате химического или физико-химического взаимодействия с окружающей средой. Но следует учитывать, что механизмы и кинетика процессов для неметаллов и металлов будут разными.
Коррозия металлов
Образование гальванических пар с пользой применяют для создания батарей и аккумуляторов. С другой стороны, образование такой пары приводит к неблагоприятному процессу, жертвой которого становится целый ряд металлов, — коррозии.
Под коррозией понимают происходящее на поверхности электрохимическое или химическое разрушение металлического материала. Наиболее часто при коррозии металл окисляется с образованием ионов металла, которые при дальнейших превращениях дают различные продукты коррозии.
Коррозия может быть вызвана как химическим, так и электрохимическим процессом. Соответственно, различают химическую и электрохимическую коррозию металлов.
Химическая коррозия
Химическая коррозия — взаимодействие поверхности металла с (коррозионно-активной) средой, не сопровождающееся возникновением электрохимических процессов на границе фаз.
В этом случае взаимодействия окисление металла и восстановление окислительного компонента коррозионной среды протекают в одном акте.
Например, образование окалины при взаимодействии материалов на основе железа при высокой температуре с кислородом:
- 4Fe + 3O2 → 2Fe2O3
- При электрохимической коррозии ионизация атомов металла и восстановление окислительного компонента коррозионной среды протекают не в одном акте и их скорости зависят от электродного потенциала металла (например, ржавление стали в морской воде).
- Электрохимическая коррозия
Разрушение металла под воздействием возникающих в коррозионной среде гальванических элементов называют электрохимической коррозией. Не следует путать с электрохимической коррозией коррозию однородного материала, например, ржавление железа или т.п.
При электрохимической коррозии (наиболее частая форма коррозии) всегда требуется наличие электролита (Конденсат, дождевая вода и т. д.), с которым соприкасаются электроды — либо различные элементы структуры материала, либо два различных соприкасающихся материала с различающимися окислительно-восстановительными потенциалами.
Если в воде растворены ионы солей, кислот, или т.п., электропроводность ее повышается, и скорость процесса увеличивается.
Коррозионный элемент
При соприкосновении двух металлов с различными окислительно-восстановительными потенциалами и погружении их в раствор электролита, например, дождевой воды с растворенным углекислым газом CO2, образуется гальванический элемент, так называемый коррозионный элемент.
Он представляет собой не что иное, как замкнутую гальваническую ячейку. В ней происходит медленное растворение металлического материала с более низким окислительно-восстановительным потенциалом; второй электрод в паре, как правило, не корродирует.
Этот вид коррозии особо присущ металлам с высокими отрицательными потенциалами. Так, совсем небольшого количества примеси на поверхности металла с большим редокспотенциалом уже достаточно для возникновения коррозионного элемента.
Особо подвержены риску места соприкосновения металлов с различными потенциалами, например, сварочные швы или заклёпки.
Если растворяющийся электрод коррозионно-стоек, процесс коррозии замедляется.
На этом основана, например, защита железных изделий от коррозии путём лужения или оцинковки — олово или цинк имеют более отрицательный потенциал, чем железо, поэтому в такой паре железо восстанавливается, а олово или цинк должны корродировать. Однако в связи с образованием на поверхности олова или цинка окисной плёнки процесс коррозии сильно замедляется.
- Водородная и кислородная коррозия
- Если происходит восстановление ионов H3O+ или молекул воды H2O, говорят о водородной коррозии или коррозии с водородной деполяризацией. Восстановление ионов происходит по следующей схеме:
- 2H3O+ + 2e− → 2H2O + H2
- или
- 2H2O + 2e− → 2OH− + H2
Если водород не выделяется, что часто происходит в нейтральной или сильно щелочной среде, происходит восстановление кислорода и здесь говорят о кислородной коррозии или коррозии с кислородной деполяризацией:
O2 + 2H2O + 4e− → 4OH−
Коррозионный элемент может образовываться не только при соприкосновении двух различных металлов. Коррозионный элемент образуется и в случае одного металла, если, например, структура поверхности неоднородна.
Борьба с коррозией
Коррозия приводит ежегодно к миллиардным убыткам, и разрешение этой проблемы является важной задачей. Основной ущерб, причиняемый коррозией, заключается не в потере металла как такового, а в огромной стоимости изделий, разрушаемых коррозией. Вот почему ежегодные потери от неё в промышленно развитых странах столь велики.
Истинные убытки от неё нельзя определить, оценив только прямые потери, к которым относятся стоимость разрушившейся конструкции, стоимость замены оборудования, затраты на мероприятия по защите от коррозии. Ещё больший ущерб составляют косвенные потери.
Это простои оборудования при замене прокорродировавших деталей и узлов, утечка продуктов, нарушение технологических процессов.
Идеальная защита от коррозии на 80 % обеспечивается правильной подготовкой поверхности, и только на 20 % качеством используемых лакокрасочных материалов и способом их нанесения. [2]. Наиболее производительным и эффективным методом подготовки поверхности перед дальнейшей защитой субстрата является абразивоструйная очистка[3].
- Обычно выделяют три направления методов защиты от коррозии:
- 1. Конструкционный
- 2. Активный
- 3. Пассивный
- Для предотвращения коррозии в качестве конструкционных материалов применяют нержавеющие стали, кортеновские стали, цветные металлы.
- В качестве защиты от коррозии может применяться нанесение какого-либо покрытия, которое препятствует образованию коррозионного элемента (пассивный метод).
- Кислородная коррозия оцинкованного железа
- Кислородная коррозия железа, покрытого оловом
Красочное покрытие, полимерное покрытие и эмалирование должны, прежде всего, предотвратить доступ кислорода и влаги. Часто также применяется покрытие, например, стали другими металлами, такими как цинк, олово, хром, никель. Цинковое покрытие защищает сталь даже когда покрытие частично разрушено. Цинк имеет более отрицательный потенциал и корродирует первым. Ионы Zn2+ токсичны.
При изготовлении консервных банок применяют жесть, покрытую слоем олова. В отличие от оцинкованной жести, при разрушении слоя олова корродировать, притом усиленно, начинает железо, так как олово имеет более положительный потенциал. Другая возможность защитить металл от коррозии — применение защитного электрода с большим отрицательным потенциалом, например, из цинка или магния.
Для этого специально создаётся коррозионный элемент. Защищаемый металл выступает в роли катода, и этот вид защиты называют катодной защитой. Растворяемый электрод, называют, соответственно, анодом протекторной защиты Этот метод применяют для защиты от коррозии морских судов, мостов, котельных установок, расположенных под землей труб.
Для защиты корпуса судна на наружную сторону корпуса крепят цинковые пластинки.
Если сравнить потенциалы цинка и магния с железом, они имеют более отрицательные потенциалы. Но тем не менее корродируют они медленнее вследствие образования на поверхности защитной оксидной плёнки, которая защищает металл от дальнейшей коррозии.
Образование такой плёнки называют пассивацией металла. У алюминия её усиливают анодным окислением (анодирование). При добавлении небольшого количества хрома в сталь на поверхности металла образуется оксидная плёнка.
Содержание хрома в нержавеющей стали — более 12 процентов.
- Система холодного цинкования
- Система холодного цинкования предназначена для усиления антикоррозионных свойств комплексного многослойного покрытия. Система обеспечивает полную катодную (или гальваническую) защиту железных поверхностей от коррозии в различных агрессивных средах
- Система холодной оцинковки бывает одно-, двух- или трехупаковочной и включает:
- · связующее — известны составы на хлоркаучуковой, этилсиликатной, полистирольной, эпоксидной, уретановой, алкидной (модифицированной) основе;
- · антикоррозионный наполнитель — цинковый порошок («цинковая пыль»), с содержанием более 95 % металлического цинка, имеющего размер частиц менее 10 мкм и минимальную степень окисления.;
- · отвердитель (в двух- и трех- упаковочных системах)
Одноупаковочные системы холодного цинкования поставляютмся готовыми к применению и требуют лишь тщательного перемешивания состава перед нанесением. Двух- и трехупаковочные системы могут поставляться в нескольких упаковках и требуют дополнительных операций по приготовлению состава перед нанесением (смешивание связующего, наполнителя, отвердителя).
После приготовления (двух- и трёхупаковочные системы), нанесения состава на защищаемую поверхность металла кистью, валиком, методом пневматического или безвоздушного распыления и высыхания на поверхности металла образуется цинкнаполненное противокоррозионное покрытие — полимерно-цинковая плёнка, сохраняющая все свойства полимерного покрытия, которое использовалось в качестве связующего, и одновременно обладающая всеми защитными достоинствами обычного цинкового покрытия.
Преимущества системы холодной оцинковки по сравнению со способом горячей гальванизации:
1. Простота и меньшая трудоёмкость технологии нанесения защитного цинкового покрытия. Для нанесения покрытия не требуется специальное оборудование.
2. Возможность антикоррозионной защиты металлоконструкций любых размеров, как в заводских так и в полевых условиях.
3. Возможность исправления непосредственно на месте абразивных повреждений покрытия и дефектов, возникающих при сварке металлоконструкций.
4. Экологически чистый процесс нанесения покрытия: нет необходимости производить работы в горячем цеху.
5. Создание на поверхности железа гибкого слоя цинка (не образующего микротрещин при изгибании металлоизделия).
Система холодного цинкования применяется во всех видах промышленности и в быту, где требуется надёжная и долговечная защита железных поверхностей от коррозии.
Помимо использования в качестве грунтовочного слоя в комплексном многослойном покрытии система холодной оцинковки может применяться как самостоятельное антикоррозийное покрытие металлических поверхностей.
Газотермическое напыление
Для борьбы с коррозией используют также методы газотермического напыления. С помощью газотермического напыления на поверхности металла создается слой из другого металла/сплава, обладающий более высокой стойкостью к коррозии (изолирующий) или наоборот менее стойкий (протекторный). Такой слой позволяет остановить коррозию защищаемого металла.
Термодиффузионное цинковое покрытие
(ГОСТ 9.316-2006). Для эксплуатации металлоизделий в агрессивных средах, необходима более стойкая антикоррозионная защита поверхности металлоизделий.
Термодиффузионное цинковое покрытие является анодным по отношению к черным металлам и электрохимически защищает сталь от коррозии.
Оно обладает прочным сцеплением (адгезией) с основным металлом за счет взаимной диффузии железа и цинка в поверхностных интерметаллитных фазах, поэтому не происходит отслаивания и скалывания покрытий при ударах, механических нагрузках и деформациях обработанных изделий.
Диффузионное цинкование, осуществляемое из паровой или газовой фазы при высоких температурах (375—850 °C), или с использованием разряжения (вакуума) — при температуре от 250 °C, применяется для покрытия крепёжных изделий,труб, деталей арматуры и др. конструкций.
Значительно повышает стойкость стальных, чугунных изделий в средах, содержащих сероводород (в т.ч. против сероводородного коррозионного растрескивания), промышленной атмосфере, морской воде и др. Толщина диффузионного слоя зависит от температуры, времени, способа цинкования и может составлять 0,01—1,5 мм.
Современный процесс диффузионного цинкования позволяет образовывать покрытие на резьбовых поверхностях крепёжных изделий, без затруднения их последующего свинчивания. Микротвёрдость слоя покрытия Hμ = 4000 – 5000 МПа. Диффузионное цинковое покрытие также значительно повышает жаростойкость стальных и чугунных изделий, при температуре до 700 °C.
Возможно получение легированных диффузионных цинковых покрытий, применяемое для повышения их служебных характеристик.
Цинкование
Цинкование — это то нанесение цинка или его сплава на металлическое изделие для придания его поверхности определённых физико-химических свойств, в первую очередь высокого сопротивления коррозии. Цинкование — наиболее распространённый и экономичный процесс металлизации, применяемый для защиты железа и его сплавов от атмосферной коррозии.
На эти цели расходуется примерно 40 % мировой добычи цинка. Толщина покрытия должна быть тем больше, чем агрессивнее окружающая среда и чем длительнее предполагаемый срок эксплуатации. Цинкованию подвергаются стальные листы, лента, проволока, крепёжные детали, детали машин и приборов, трубопроводы и др. металлоконструкции.
Декоративного назначения цинковое покрытие обычно не имеет; некоторое улучшение товарный вид приобретает после пассивирования оцинкованных изделий в хроматных, или фосфатных растворах, придающих покрытиям радужную окраску.
Наиболее широко используется оцинкованная полоса, изготовляемая на автоматизированных линиях горячего цинкования, то есть методом погружения в расплавленный цинк.
Методы распыления («холодное цинкование» [4]) и металлизация позволяют покрывать изделия любого размера (например, мачты электропередач, резервуары, мостовые металлоконструкции, дорожные ограждения). Электролитическое цинкование ведётся в основном из кислых и щёлочно-цианистых электролитов; специальные добавки позволяют получать блестящие покрытия.
Экономический ущерб от коррозии
Экономические потери от коррозии металлов огромны. В США по последним данным NACE [5] ущерб от коррозии и затраты на борьбу с ней составили 3,1 % от ВВП (276 млрд. долларов). В Германии этот ущерб составил 2,8 % от ВВП.
По оценкам специалистов различных стран эти потери в промышленно развитых странах составляют от 2 до 4 % валового национального продукта.
При этом потери металла, включающие массу вышедших из строя металлических конструкций, изделий, оборудования, составляют от 10 до 20 % годового производства стали.[6]
Ржавчина является одной из наиболее распространенных причин аварий мостов. Так как ржавчина имеет гораздо больший объём, чем исходная масса железа, её наращивание может привести к неравномерному прилеганию друг к друга конструкционных деталей.
Это стало причиной разрушения моста через реку Мианус в 1983 году, когда подшипники подъёмного механизма проржавели внутри. Три водителя погибли при падении в реку. Исследования показали, что сток дороги был перекрыт и не были почищен, а сточные воды проникли в опоры моста.
[7] 15 декабря 1967 года Серебряный мост, соединяющий Поинт Плезант, штат Западная Виржиния, и Канауга, штат Огайо, неожиданно рухнул в реку Огайо. В момент обрушения 37 автомобилей двигались по мосту, и 31 из них упали вместе с мостом. Сорок шесть человек погибли, и девять серьезно пострадали.
Помимо человеческих жертв и травм, был разрушен основной транспортный путь между Западной Виржинией и Огайо. Причиной обрушения стала коррозия. [8]
Источник: https://www.neuch.ru/referat/93463.html