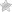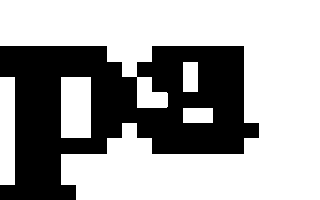Углерод — химический элемент № (6). Он расположен в IVА группе Периодической системы.
C6+6)2e)4e
На внешнем слое атома углерода содержатся четыре валентных электрона, и до его завершения не хватает четырёх электронов. Поэтому в соединениях с металлами углероду характерна степень окисления (–4), а при взаимодействии с более электроотрицательными неметаллами он проявляет положительные степени окисления: ( +2) или (+4).
В природе углерод встречается как в виде простых веществ, так и в виде соединений. В воздухе содержится углекислый газ.
В земной коре распространены карбонаты (например, CaCO3 образует мел, мрамор, известняк).
Горючие ископаемые (уголь, торф, нефть, природный газ) состоят из органических соединений, главным элементом которых является углерод.
Углерод относится к жизненно важным элементам, так как входит в состав молекул всех органических веществ.
Углерод образует несколько аллотропных видоизменений, из которых наиболее известны алмаз и графит.
Алмаз имеет атомную кристаллическую решётку. Каждый атом углерода в алмазе связан четырьмя прочными ковалентными связями с соседними атомами, расположенными в вершинах тетраэдра.
Благодаря такому строению алмаз — самое твёрдое из известных природных веществ. Все четыре валентных электрона каждого атома углерода участвуют в образовании связей, поэтому алмаз не проводит электрический ток. Это бесцветное прозрачное кристаллическое вещество, хорошо преломляющее свет.
Графит тоже имеет атомную кристаллическую решётку, но устроена она иначе. Решётка графита слоистая. Каждый атом углерода соединён прочными ковалентными связями с тремя соседними атомами. Образуются плоские слои из шестиугольников, которые между собой связаны слабо. Один валентный электрон у атома углерода остаётся свободным.
Графит представляет собой тёмно-серое вещество с металлическим блеском, жирное на ощупь. В отличие от алмаза графит непрозрачный, проводит электрический ток и оставляет серый след на бумаге. У графита очень высокая температура плавления ((3700) °С).
Алмаз и графит взаимопревращаемы. При сильном нагревании без доступа воздуха алмаз чернеет и превращается в графит. Графит можно превратить в алмаз при высокой температуре и большом давлении.
Из мельчайших частиц графита состоят сажа, древесный уголь и кокс. Сажа образуется при неполном сгорании топлива. Древесный уголь получают при нагревании древесины без доступа воздуха, а кокс — переработкой каменного угля.
Древесный уголь имеет пористое строение и обладает способностью поглощать газы и растворённые вещества. Такое свойство называется адсорбцией.
Аллотропные модификации углерода в химических реакциях могут проявлять и окислительные, и восстановительные свойства. Окислительные свойства углерода выражены слабее, чем у других неметаллов второго периода (азота, кислорода и фтора).
- Взаимодействие с металлами.
- Углерод реагирует с металлами при высокой температуре с образованием карбидов:
- 4Al0+3C0=tAl+34C−43.
- В этой реакции углерод выступает как окислитель.
- Взаимодействие с водородом.
Реакция происходит при сильном нагревании. Образуется метан. Углерод — окислитель.
C0+2H02=tC−4H+14.
- Взаимодействие с кислородом.
Углерод горит в кислороде с образованием углекислого газа и проявляет в этой реакции восстановительные свойства:
C0+O02=tC+4O−22.
- Взаимодействие с оксидами металлов.
- Углерод способен восстанавливать металлы из их оксидов:
- 2Cu+2O+C0=t2Cu0+C+4O2.
- Применение простых веществ
- Алмаз применяется:
- для обработки твёрдых поверхностей;
- для резки стекла;
- для изготовления буров и свёрл;
- для изготовления ювелирных украшений.
Графит используется:
- при изготовлении карандашей;
- как твёрдая смазка в подшипниках;
- для изготовления электродов;
- в качестве замедлителя нейтронов в ядерных реакторах;
- для получения искусственных алмазов.
Сажа:
- входит в состав типографской краски, крема для обуви;
- используется как наполнитель для производства резины.
Уголь используется:
- в противогазах, промышленных и бытовых фильтрах;
- для очистки сахарного сиропа, спирта и т. д.;
- в медицине.
Кокс применяется в металлургической промышленности.
Источник: https://www.yaklass.ru/p/himija/89-klass/khimiia-nemetallov-157456/uglerod-i-ego-soedineniia-163475/re-28df6da6-8e46-4344-9b2d-1694f2fff357
Углерод — характеристика элемента и химические свойства
Характеристика углерода. Свойства простых веществ и соединений
Углерод (С) – типичный неметалл; в периодической системе находится в 2-м периоде IV группе, главной подгруппе. Порядковый номер 6, Ar = 12,011 а.е.м., заряд ядра +6.
Физические свойства: углерод образует множество аллотропных модификаций: алмаз – одно из самых твердых веществ, графит, уголь, сажа.
Атом углерода имеет 6 электронов: 1s22s22p2. Последние два электрона располагаются на отдельных р-орбиталях и являются неспаренными. В принципе, эта пара могла бы занимать одну орбиталь, но в таком случае сильно возрастает межэлектронное отталкивание. По этой причине один из них занимает 2рх, а другой, либо 2ру, либо 2рz-орбитали.
Различие энергии s- и р-подуровней внешнего слоя невелико, поэтому атом довольно легко переходит в возбужденное состояние, при котором один из двух электронов с 2s-орбитали переходит на свободную 2р. Возникает валентное состояние, имеющее конфигурацию 1s22s12px12py12pz1. Именно такое состояние атома углерода характерно для решетки алмаза — тетраэдрическое пространственное расположение гибридных орбиталей, одинаковая длина и энергия связей.
Это явление, как известно, называют sp3-гибридизацией, а возникающие функции – sp3-гибридными. Образование четырех sp3-cвязeй обеспечивает атому углерода более устойчивое состояние, чем три р—р- и одна s—s-связи.
Помимо sp3-гибридизации у атома углерода наблюдается также sp2— и sp-гибридизация. В первом случае возникает взаимное наложение s- и двух р-орбиталей. Образуются три равнозначные sp2— гибридных орбитали, расположенные в одной плоскости под углом 120° друг к другу.
Третья орбиталь р неизменна и направлена перпендикулярно плоскости sp2.
При sp-гибридизации происходит наложение орбиталей s и р. Между двумя образующимися равноценными гибридными орбиталями возникает угол 180°, при этом две р-орбитали у каждого из атомов остаются неизменными.
Аллотрорпия углерода. Алмаз и графит
В кристалле графита атомы углерода расположены в параллельных плоскостях, занимая в них вершины правильных шестиугольников. Каждый из атомов углерода связан с тремя соседними sp2-гибридными связями. Между параллельными плоскостями связь осуществляется за счет ван-дер-ваальсовых сил.
Свободные р-орбитали каждого из атомов направлены перпендикулярно плоскостям ковалентных связей. Их перекрыванием объясняется дополнительная π-связь между атомами углерода.
Таким образом, от валентного состояния, в котором находятся атомы углерода в веществе, зависят свойства этого вещества.
Химические свойства углерода
Наиболее характерные степени окисления: +4, +2.
При низких температурах углерод инертен, но при нагревании его активность возрастает.
Углерод как восстановитель:
- — с кислородом
C0 + O2 –t°= CO2 углекислый газ
при недостатке кислорода — неполное сгорание: - 2C0 + O2 –t°= 2C+2O угарный газ
- — со фтором
С + 2F2 = CF4 - — с водяным паром
C0 + H2O –1200°= С+2O + H2 водяной газ
— с оксидами металлов. Таким образом выплавляют металл из руды.
C0 + 2CuO –t°= 2Cu + C+4O2
— с кислотами – окислителями:
C0 + 2H2SO4(конц.) = С+4O2 + 2SO2 + 2H2O
С0 + 4HNO3(конц.) = С+4O2 + 4NO2 + 2H2O
— с серой образует сероуглерод:
С + 2S2 = СS2.
Углерод как окислитель:
- — с некоторыми металлами образует карбиды
- 4Al + 3C0 = Al4C3
- Ca + 2C0 = CaC2-4
- — с водородом — метан (а также огромное количество органических соединений)
- C0 + 2H2 = CH4
- — с кремнием, образует карборунд (при 2000 °C в электропечи):
- Si + C = SiC.
Нахождение углерода в природе
Ссвободный углерод встречается в виде алмаза и графита.
В виде соединений углерод находится в составе минералов: мела, мрамора, известняка – СаСО3, доломита – MgCO3*CaCO3; гидрокарбонатов – Mg(НCO3)2 и Са(НCO3)2, СО2 входит в состав воздуха; углерод является главной составной частью природных органических соединений – газа, нефти, каменного угля, торфа, входит в состав органических веществ, белков, жиров, углеводов, аминокислот, входящих в состав живых организмов.
Неорганические соединения углерода
Ни ионы С4+ , ни С4- ‑ ни при каких обычных химических процессах не образуются: в соединениях углерода имеются ковалентные связи различной полярности.
Оксид углерода (II) СО
Угарный газ; бесцветный, без запаха, малорастворим в воде, растворим в органических растворителях, ядовит, t°кип = -192°C; t пл. = -205°C.
- Получение
1) В промышленности (в газогенераторах): - C + O2 = CO2
- CO2 + C = 2CO
- 2) В лаборатории — термическим разложением муравьиной или щавелевой кислоты в присутствии H2SO4(конц.):
HCOOH = H2O + CO - H2C2O4 = CO + CO2 + H2O
- Химические свойства
- При обычных условиях CO инертен; при нагревании – восстановитель; несолеобразующий оксид.
- 1) с кислородом
- 2C+2O + O2 = 2C+4O2
- 2) с оксидами металлов
- C+2O + CuO = Сu + C+4O2
- 3) с хлором (на свету)
- CO + Cl2 –hn= COCl2(фосген)
- 4) реагирует с расплавами щелочей (под давлением)
- CO + NaOH = HCOONa (формиат натрия)
- 5) с переходными металлами образует карбонилы
- Ni + 4CO –t°= Ni(CO)4
- Fe + 5CO –t°= Fe(CO)5
Оксид углерода (IV) СO2
Углекислый газ, бесцветный, без запаха, растворимость в воде — в 1V H2O растворяется 0,9V CO2 (при нормальных условиях); тяжелее воздуха; t°пл.= -78,5°C (твёрдый CO2 называется «сухой лёд»); не поддерживает горение.
Получение
- Термическим разложением солей угольной кислоты (карбонатов). Обжиг известняка:
CaCO3 –t°= CaO + CO2
- Действием сильных кислот на карбонаты и гидрокарбонаты:
- CaCO3 + 2HCl = CaCl2 + H2O + CO2
- NaHCO3 + HCl = NaCl + H2O + CO2
- Химические свойства СO2
Кислотный оксид: реагирует с основными оксидами и основаниями, образуя соли угольной кислоты - Na2O + CO2 = Na2CO3
- 2NaOH + CO2 = Na2CO3 + H2O
- NaOH + CO2 = NaHCO3
- При повышенной температуре может проявлять окислительные свойства
- С+4O2 + 2Mg –t°= 2Mg+2O + C0
- Качественная реакция
- Помутнение известковой воды:
- Ca(OH)2 + CO2 = CaCO3¯(белый осадок) + H2O
Оно исчезает при длительном пропускании CO2 через известковую воду, т.к. нерастворимый карбонат кальция переходит в растворимый гидрокарбонат:
CaCO3 + H2O + CO2 = Сa(HCO3)2
Угольная кислота и её соли
- H2CO3 — Кислота слабая, существует только в водном растворе:
- CO2 + H2O ↔ H2CO3
- Двухосновная:
H2CO3 ↔ H+ + HCO3— Кислые соли — бикарбонаты, гидрокарбонаты
HCO3— ↔ H+ + CO32- Cредние соли — карбонаты - Характерны все свойства кислот.
- Карбонаты и гидрокарбонаты могут превращаться друг в друга:
- 2NaHCO3 –t°= Na2CO3 + H2O + CO2
- Na2CO3 + H2O + CO2 = 2NaHCO3
- Карбонаты металлов (кроме щелочных металлов) при нагревании декарбоксилируются с образованием оксида:
- CuCO3 –t°= CuO + CO2
- Качественная реакция — «вскипание» при действии сильной кислоты:
- Na2CO3 + 2HCl = 2NaCl + H2O + CO2
- CO32- + 2H+ = H2O + CO2
Карбиды
- Карбид кальция:
- CaO + 3 C = CaC2 + CO
- CaC2 + 2 H2O = Ca(OH)2 + C2H2 .
- Ацетилен выделяется при реакции с водой карбидов цинка, кадмия, лантана и церия:
- 2 LaC2 + 6 H2O = 2La(OH)3 + 2 C2H2 + H2.
- Be2C и Al4C3 разлагаются водой с образованием метана:
- Al4C3 + 12 H2O = 4 Al(OH)3 = 3 CH4.
- В технике применяют карбиды титана TiC, вольфрама W2C (твердые сплавы), кремния SiC (карборунд – в качестве абразива и материала для нагревателей).
Цианиды
получают при нагревании соды в атмосфере аммиака и угарного газа:
Na2CO3 + 2 NH3 + 3 CO = 2 NaCN + 2 H2O + H2 + 2 CO2
Синильная кислота HCN – важный продукт химической промышленности, широко применяется в органическом синтезе. Ее мировое производство достигает 200 тыс. т в год. Электронное строение цианид-аниона аналогично оксиду углерода (II), такие частицы называют изоэлектронными:
- C=O: [:C=N:]–
- Цианиды (0,1-0,2%-ный водный раствор) применяют при добыче золота:
- 2 Au + 4 KCN + H2O + 0,5 O2 = 2 K[Au(CN)2] + 2 KOH.
- При кипячении растворов цианидов с серой или сплавлении твердых веществ образуются роданиды:
KCN + S = KSCN. - При нагревании цианидов малоактивных металлов получается дициан: Hg(CN)2 = Hg + (CN)2. Растворы цианидов окисляются до цианатов:
- 2 KCN + O2 = 2 KOCN.
- Циановая кислота существует в двух формах:
- H-N=C=O; H-O-C=N:
В 1828 г. Фридрих Вёлер (1800-1882) получил из цианата аммония мочевину: NH4OCN = CO(NH2)2 при упаривании водного раствора.
Это событие обычно рассматривается как победа синтетической химии над «виталистической теорией».
Существует изомер циановой кислоты – гремучая кислота
H-O-N=C.
Ее соли (гремучая ртуть Hg(ONC)2) используются в ударных воспламенителях.
Синтез мочевины (карбамида):
CO2 + 2 NH3 = CO(NH2)2 + H2O. При 1300С и 100 атм.
Мочевина является амидом угольной кислоты, существует и ее «азотный аналог» – гуанидин.
Карбонаты
Важнейшие неорганические соединения углерода – соли угольной кислоты (карбонаты). H2CO3 – слабая кислота (К1 =1,3·10-4; К2 =5·10-11). Карбонатный буфер поддерживает углекислотное равновесие в атмосфере. Мировой океан обладает огромной буферной емкостью, потому что он является открытой системой. Основная буферная реакция – равновесие при диссоциации угольной кислоты:
- H2CO3 ↔ H+ + HCO3— .
- При понижении кислотности происходит дополнительное поглощение углекислого газа из атмосферы с образованием кислоты:
CO2 + H2O ↔ H2CO3 . - При повышении кислотности происходит растворение карбонатных пород (раковины, меловые и известняковые отложения в океане); этим компенсируется убыль гидрокарбонатных ионов:
- H+ + CO32-↔ HCO3—
- CaCO3(тв.) ↔ Ca2+ + CO32-
Твердые карбонаты переходят в растворимые гидрокарбонаты. Именно этот процесс химического растворения избыточного углекислого газа противодействует «парниковому эффекту» – глобальному потеплению из-за поглощения углекислым газом теплового излучения Земли. Примерно треть мирового производства соды (карбонат натрия Na2CO3) используется в производстве стекла.
Источник: http://himege.ru/uglerod-xarakteristika-elementa-i-ximicheskie-svojstva/
Углерод
Углерод — это, пожалуй, основной и самый удивительный химический элемент на Земле, ведь с его помощью формируется колоссальное количество разнообразных соединений, как неорганических, так и органических. Углерод является основой всех живых существ, можно сказать, что углерод, наравне с водой и кислородом, — основа жизни на нашей планете! Углерод имеет разнообразие форм, которые не похожи ни по своим физико-химическим свойствам, ни по внешнему виду. Но всё это углерод!
История открытия углерода
Углерод был известен человечеству ещё с глубокой древности. Графит и уголь использовались ещё древними греками, а алмазы нашли применение в Индии. Правда, за графит частенько принимали похожие по внешнему виду соединения. Тем не менее, графит имел широкое применение в древности, в частности для письма.
Даже его название происходит от греческого слова «графо» — «пишу». Графит сейчас используется в карандашах. Алмазами начали впервые торговать в Бразилии в первой половине 18 века, с этого времени открыто множество месторождений, а в 1970 году была разработана технология получения алмазов искусственным путём.
Такие искусственные алмазы применяются в промышленности, натуральные же, в свою очередь, в ювелирном деле.
Углерод в природе
Содержание углерода в земной коре составляет всего около 0,15%. Казалось бы, один из основных элементов, а так мало… На самом деле, углерод подвержен постоянному круговороту из земной коры через биосферу в атмосферу и наоборот. Из углерода состоят природный газ, нефть, уголь, торф, известняки и многие другие соединения.
Наиболее значимое количество углерода собрано в атмосфере и гидросфере в виде углекислого газа. В атмосфере углерода содержится около 0,046%, а еще больше — в растворенном виде в Мировом Океане.
Кроме того, как мы видели выше, углерод является основой живых организмов. Например, в теле человека массой 70 кг содержится около 13 кг углерода! Это только в одном человеке! А углерод содержится также во всех растениях и животных. Вот и считайте…
Круговорот углерода в природе
Аллотропные модификации углерода
Углерод — уникальный химический элемент, который образует так называемые аллотропные модификации, или, проще говоря, различные формы. Эти модификации подразделяются кристаллические, аморфные и в виде кластеров.
Кристаллические модификации имеют правильную кристаллическую решётку. К этой группе относятся: алмаз, фуллерит, графит, лонсдейлит, углеродные волокна и трубки. Подавляющее большинство кристаллических модификаций углерода на первых местах в рейтинге «Самые твёрдые материалы в мире» .
Аллотропные формы углерода: a) лонсдейлит; б) алмаз;в) графит; г) аморфный углерод; д) C60 (фуллерен); е) графен;
ж) однослойная нанотрубка
Аморфные формы образованы углеродом с небольшими примесями других химических элементов. Основные представители этой группы: уголь (каменный, древесный, активированный), сажа, антрацит.
Самыми сложными и высокотехнологичными являются соединения углерода в виде кластеров. Кластеры — это особая структура, при которой атомы углерода расположены таким образом, что образуют полую форму, которая заполнена изнутри атомами других элементов, например, воды. В этой группе не так уж и много представителей, в неё входят углеродные наноконусы, астралены и диуглерод.
Графит — «тёмная сторона» алмаза
Применение углерода
Углерод и его соединения имеют огромное значение в жизнедеятельности человека. Из углерода образованы главные виды топлива на Земле — природный газ и нефть. Соединения углерода широко применяются в химической и металлургической промышленности, в строительстве, в машиностроении и медицине.
Аллотропные модификации в виде алмазов используют в ювелирном деле, фуллерит и лонсдейлит в ракетостроении. Из соединений углерода изготавливаются различные смазки для механизмов, техническое оборудование и многое другое.
Промышленность в настоящее время не может обойтись без углерода, он используется везде!
Источник: http://www.alto-lab.ru/elements/uglerod/
Аллотропные видоизменения углерода: графит и алмаз
- Аллотропные
видоизменения углерода: графит и алмаз - Сообщение
подготовила Попова Катя, 9 г класс - Углерод.
- С – химический
элемент IV группы
периодической системы Менделеева, атомный номер 6, относительная атомная масса
12, 011(1). - Многообразие
соединений углерода, объясняющееся способностью его атомов соединяться друг с
другом и атомами других элементов различными способами, обусловливает особое
положение углерода среди других элементов. - Аллотропные
видоизменения углерода. - Элементарный
углерод образует три аллотропных видоизменения: алмаз, графит и карбин.
Алмаз – бесцветное, прозрачное
кристаллическое вещество, чрезвычайно сильно преломляющее лучи света. Атомы
углерода в алмазе находятся в состоянии sp3-гибридизации. В возбужденном состоянии
происходит распаривание валентных электронов в атомах углерода и образование
четырех не спаренных электронов.
Каждый
атом углерода в алмазе окружен четырьмя другими, расположенными от него в
направлении от центра в тетраэдров к
вершинам. Расстояние между атомами в тетраэдрах равно 0, 154 нм. Прочность всех связей одинакова. Таким образом,
атомы в алмазе «упакованы» очень плотно. При 20оС плотность алмаза составляет
3,1515 г/см3 . Этим объясняется его исключительная твердость. Алмаз плохо
проводит электрический ток. Основная масса , образования алмазов – небольшие
кристаллы и алмазная пыль.
Алмазы при
нагревании без доступа воздуха выше 1000оС превращается в графит. При 1750оС превращение алмаза в графит
происходит быстро.
Графит –
серо-черное кристаллическое вещество с металлическим блеском, жирное на ощупь,
по твердости уступает даже бумаге.
Атомы
углерода в кристаллах графита находятся в состоянии sp2 – гибридизации: каждый из них образует
трех ковалентные ơ-связис соседними атомами. Углы между направлениями
связей равна 120о. В результате образуется сетка, состоящая из правильных шестиугольников.
Расстояние между соседними ядрами атомов углерода внутри слоя составляет
0,142нм.
Графит имеет
низкую механическую прочность и легко расщепляется на чешуйки, которые сами по
себе очень прочны. Связь между слоями атомов углерода в графите частично имеет
металлический характер. Этим объясняется тот факт, что графит хорошо проводит
электрический ток, но все же не так, как металл.
При
нагревании без доступа воздуха графит не претерпевает никакого изменения до
3700оС. При указанной температуре он выгоняется, не плавясь. Графит
термодинамичен, устойчив в широком интервале температур и давлений. Плотность
составляет 2,256 г/см3.
Применение.
Алмазы
используются для обработки различных твердых материалов, для резки, шлифования,
сверления и гравировки стекла, для бурения горных пород. Алмазы после шлифовки
и огранки превращаются в бриллианты, которые используются как украшения.
Из графита
изготовляют литейные формы, плавильные тигли, огнеупорные изделия. Значимое
количества графита используется в электротехнической промышленности, например,
при изготовлении электродов. Графит используется для изготовления карандашей,
красок. Чистый графит используется в ядерных реакторах для замедления нейронов.
Дата добавления: 17.01.2004
Источник: https://www.km.ru/referats/10AB82A810F4498F84229AD24A505F96
Углерод — основа жизни на Земле
- Мы посвятили две статьи воздуху, без которого жизнь на нашей планете была бы невозможна. Теперь поговорим об углероде — элементе, который является основой жизни на земле. Ученые, уфологи и фантасты даже ввели в обиход термин «углеродная жизнь». И он вполне справедлив, так как все белки, аминокислоты, жиры, ДНК и РНК построены на основе углеводородных молекул.Углерод — простое неорганическое вещество, элемент таблицы Менделеева. Обозначается буквой «С» (Carboneum). В виде алмазов, графита и древесного угля известен человечеству с древнейших времен. Название carbone (углерод) впервые было введено в химическую науку французскими учеными. А. Лавуазье доказал, что уголь — это элементарное химическое вещество, а не носитель некоего невесомого флюида флогистона, отвечающего за горючие свойства веществ. Он же установил, что алмаз — это кристаллическая форма углерода.
Три формы углерода
Углерод — удивительное вещество, физические свойства которого и даже внешний вид описать однозначно просто невозможно. Этот элемент — рекордсмен по количеству аллотропных модификаций. Три формы углерода:• кристаллическая: алмазы, наноалмазы, фуллерены, фуллерит, графиты, карбины, лонсдейлиты, углеродные нанотрубки и нановолокна, графен, волокна и структуры;• аморфная: угли (древесный, в том числе активированный уголь, антрацит и др.), коксы, сажа, углеродная нанопена, стеклоуглерод, техуглерод;• кластерная: астралены, диуглерод, углеродные наноконусы.
Вещества, относящиеся к аморфным формам, не являются чистой формой углерода, но содержат углерод в очень значительных количествах.
Для аморфного углерода характерна высокая теплоемкость, свойства полупроводников, невысокая плотность, относительно невысокая термостойкость — при температуре выше 1600 °С он превращается в графит.
Как правило, их основой являются разные формы мелкокристаллического графита в виде неупорядочной структуры.
Углеродные кластеры — сложные соединения с очень интересными свойствами. Им, а также другим перспективным материалам на основе углерода, мы посвятим одну из ближайших статей.
Химические свойства
С химическими свойствами немного проще. В нормальных условиях углерод практически не вступает в реакции с другими элементами и веществами, инертен к кислотам, щелочам, галогенам.
При высоких температурах проявляет сильные восстановительные свойства. Наиболее химически активны аморфные виды углерода, наиболее инертны — кристаллические. Графит по химической активности занимает серединное положение.
При высоких температурах углерод окисляется кислородом (горит), образует несколько видов оксидов.
Графит и аморфный углерод при высоких температурах реагируют с водородом, азотом, фтором, галогенами, щелочными металлами, солями металлов, серой. В результате реакции с водородом и азотом получается синильная кислота. Взаимодействие большинства металлов, углерода, бора и кремния приводит к образованию карбидов. Углерод восстанавливает оксиды металлов до металлов. При определенных условиях удается преобразовать углерод, содержащийся в твердых видах топлива, в горючие газы (реакция газификации топлив очень важна для промышленности).
Главное свойство углерода — способность соединяться в длинные цепи, причем эти цепи могут содержать как атомы углерода, так и другие атомы. Цепи могут замыкаться, разветвляться, образовывать циклы, быть разной длины, соединяться («сшиваться») между собой в разнообразные структуры. Такие углеродно-водородные цепи — основа всей органической химии.
Следующая статья будет о содержании углерода в природе, его опасности и сферах применения.
Источник: https://pcgroup.ru/blog/uglerod-osnova-zhizni-na-zemle/
Многоликий углерод
Например, алмаз имеет объёмную тетраэдрическую структуру, где каждый атом углерода окружён четырьмя такими же атомами, то есть, они образуют правильную четырёхгранную пирамиду.
Красота и симметрия алмазной структуры объясняются тем, что атом углерода в алмазе проявляет валентность равную IV (четырём), то есть каждый атом углерода должен образовать химическую связь с другими четырьмя атомами.
Очень прочные химические связи между атомами углерода объясняют его необычайную твёрдость. Твёрже природа ещё не создавала. Чтобы понять, как устроена алмазная кристаллическая решётка, приведём наглядный пример.
Представьте себе инопланетных воинов, которые имеют круглое тело и четыре руки. К тому же, эти руки одинаковой длины и силы, и расположены они на теле равномерно и симметрично. А теперь представим, что эти воины сцепили свои руки, причём один воин крепко держит каждой рукой за руки других четырёх воинов.
При таком построении каждый воин окажется в центре воображаемого куба, в окружении четырёх боевых товарищей. Расстояния между воинами настолько малы, что не дают никаких шансов пробиться вражеским лазутчикам. Это монолитная армия, в которой все солдаты одинаково сильны и выстроены в максимально плотный объёмный строй.
В таком строе нет слабого звена и в нём невозможно пробить брешь.
Теперь представим, что каждый воин будет держаться за руки только с тремя воинами, а четвёртую руку оставляет свободной (держит её в резерве). При такой схеме воины могут выстраиваться только в «плоские» по структуре отряды, которые затем располагаются параллельными слоями друг над другом.
Получается красивый парадный строй. Связь между воинами внутри одного отряда очень крепка и прочна, а между отрядами, к сожалению, слабая. Поэтому, какой бы многочисленной ни была эта армия, до мощи «алмазной» армии ей никогда не дотянуться.
Она будет легко разобщена на отряды, а впоследствии и разбита.
При помощи этой аналогии можно объяснить строение графита.
Графит имеет плоскостную многослойную атомную решётку, в которой атомы углерода, лежащие в одном слое (плоскости), прочно связаны с тремя другими атомами в правильные шестиугольники.
Но из-за относительно большого расстояния между слоями, связи между ними слабые. Графитовые карандаши потому и рисуют, что один слой атомов легко отслаивается от другого, и вещество оставляет след на бумаге.
Если сравнивать алмаз и графит, то можно наблюдать такой парадокс: алмаз имеет самую высокую твёрдость, равную 10 баллам по шкале Мооса, а графит – самую маленькую, равную 1 баллу, алмаз не проводит ни электрический ток, ни тепло, а графит – отличный проводник тепла и электричества.
Таким образом, мы увидели, что в алмазе и графите атомы углерода занимают строго определённые места. Поэтому их называют кристаллическими модификациями углерода.
А вот если атомы углерода «распихать» бессистемно, беспорядочно и хаотично, то получится уголь или другие вещества, например, кокс, сажа, активированный уголь и др. Такие разновидности углерода называются аморфными модификациями.
Источник: https://oyla.xyz/article/mnogolikij-uglerod
Интересные факты об углероде Доклад
Интересные факты об углероде Доклад по химии 8 класс
Углерод — это один из химических элементов. Он занимает 6-ю позицию в таблице Менделеева. На сегодня открыто больше 100 химических элементов. Причем, атомы разных элементов устроены примерно одинаково.
У каждого в центре расположено ядро, с положительным электрическим зарядом. А вокруг него двигаются электроны. Отличаются разные химические элементы между собой только числом протонов в ядре атома.
Но именно углерод, в ядре атома которое присутствуют шесть протонов, это важнейший и интереснейший по своим свойствам химический элемент.
В этом докладе интересные факты об углероде доклад
Углерод признаётся основой жизни. Любые органические вещества, являющиеся основой тканей всех живых организмов, в своём составе обязательно содержат углерод. Благодаря уникальным способностям углеродных атомов связываться в длинные цепи, в природе присутствуют достаточно сложные и большие, кроме того, разные свойствам молекулы, из которых строятся ткани живых организмов.
Некоторые большие органические молекулы, например ДНК, включают в себя десятки и сотни млн атомов. Количество изученных, на сегодняшний день, соединений углерода достигает 10 000 000.
Причём, это в разы превышает число соединений всех других элементов, вместе взятых. Поэтому, современная химия подразделяется на 2 части.
Органическая химия — изучает исключительно соединения углерода, а неорганическая химия — всё остальное.
Аллотропные видоизменения углерода
Углерод образует наибольшее количество аллотропных видоизменений. Даже из чистого углерода состоит множество абсолютно разных веществ. Наиболее известные среди них — это графит и алмаз.
Оба состоят исключительно из углерода. Но, из-за разного расположения атомов, они обладают совершенно разными свойствами. Вообще, аллотропных модификаций углерода множество.
И каждое из них имеет уникальные свойства.
Например, нанотрубки из углерода в 10 раз более прочны и в 6 раз легче чем сталь. А фуллерит в 1,5 раза превосходит по твёрдости алмаз. Графен способен выдержать электрический ток в 1 000 000 раз более сильный, чем выдерживает медь. Благодаря этому, на его основе делают сверхмалые транзисторы и др.
элементы электросхем. А недавно из графена и углеродных нанотрубок в Китае получили уникальный аэрогель. Это твёрдый и прочный материал. Но он при этом несколько раз легче воздуха. А ещё, его можно растягивать и сжимать, не разрушая. Ещё он может впитывать воды в 900 раз больше чем его собственная масса.
Тугоплавкость углерода
Углерод очень тугоплавок. Он самый тугоплавкий среди простых веществ. Температура его плавления 3700 °С.
Например, у вольфрама, из которого изготавливают нити накаливания для электрических ламп, температура плавления всего 3400 °С.
Более высокую температуру плавления, чем у углерода, имеют лишь его соединения. К примеру, у сплава карбидов гафния и тантала температура плавления более 4200 °С.
Углерод является компонентом стали. Роль железа в развитии цивилизации широко известна. Но чистое железо — весьма пластичное и мягкое вещество.
Твёрдости ему добавляет углерод, проникающий в расплавленное железо при выплавке его из железной руды. Путем сплавления железа с углеродом получают сталь.
Изменяя процентное содержание углерода можно получить стали с разными свойствами, используемые для различных целей.
Это всё про интересные факты об углероде Доклад Желаю Вам успехов в учёбе!
Источник: https://akwin.ru/interesnie-fakti-ob-uglerode-doklad/
Углерод
Углерод С находится в периодической таблице Менделеева под номером 6. Еще первобытные люди обратили внимание, что после сжигания древесины образуется уголь, которым можно рисовать на стенах пещеры. В составе любых органических соединений есть углерод. Наиболее изучены две аллотропные модификации углерода: графит и алмаз.
Графит — мягкое черное вещество, которое легко оставляет следы на бумаге, имеет металлический блеск.
Помимо этого, графит является отличным проводником тепла и электрического тока. Графит используют в промышленности для изготовления графитных смазок, а также для производства карандашей.
Графитовый сланец [Deposit Photos]
В отличие от графита, структура алмаза (другой аллотропной модификации) напоминает тетраэдр. Кроме углерода, в состав алмаза также входят хром, кремний, алюминий, марганец, титан, железо. Наибольшую долю в составе алмаза углерод делит с азотом.
Благодаря своей структуре он не проводит электрический ток и обладает слабой теплопроводностью. Алмазы используют для изготовления драгоценных камней — бриллиантов.
Искусственно созданные алмазы используют для изготовления режущих инструментов, абразивных материалов.
[Wikipedia]
Еще одной аллотропной модификацией углерода признан фуллерен. Он состоит из множества атомов углерода, соединенных ковалентными связями.
Молекулы в сложной структуре фуллерена удерживаются электростатическими и вандерваальсовыми силами. Свойства фуллерена еще не до конца изучены.
Но уже известно, что благодаря своей способности поглощать свободные радикалы эта аллотропная модификация углерода может применяться при изготовлении лекарств.
Молекула фуллерена [Deposit Photos]
- 1. Углерод является неметаллом и способен взаимодействовать с металлами и образовывать карбиды:
- Ca + 2C = CaC₂
- 2. В кислородной среде углерод сгорает в два этапа:
- 2С + O₂ = 2CO
- 2СO₂ + О₂ = 2СО₂
- 3. При взаимодействии углерода и водорода получается органическое вещество — метан:
- С + 2H₂ = CH₄
- 4. При испарении воды под раскаленным углем образуются угарный газ и водород:
- C + H₂O = CO + H₂
- 5. Углерод не реагирует с хлором, бромом и йодом, но взаимодействует со фтором:
- С + 2F₂ = CF₄
- 6. Реагирует с серой:
- С + 2S = CS₂
- 7. Углерод способен восстанавливать металлы из их оксидов:
- 2ZnO + C = 2Zn + CO₂
- 8. При повышении температуры реакции углерод взаимодействует с серной кислотой:
- C + 2H₂SO₄ = CO₂ + 2SO₂ + 2H₂O
- Чтобы лучше изучить свойства этого элемента, рекомендуем провести несколько наглядных экспериментов.
Углерод в органической химии
Углерод занимает особое место в периодической cистеме. Благодаря своему строению он образует длинные цепочки связей линейной или циклической структуры. Известно более 10 миллионов органических соединений. Несмотря на свое разнообразие, на воздухе и под действием температуры они всегда будут превращаться в углекислый газ и воду.
[Deposit Photos]
Роль углерода в нашей повседневной жизни огромна. Без углекислого газа не будет происходить фотосинтез — один из основных биологических процессов.
Применение углерода
Углерод широко применяется в медицине для создания различных лекарств органической природы. Изотопы углерода позволяют проводить радиоуглеродный анализ. Без углерода невозможна работа металлургической промышленности.
Уголь, сгорающий в твердотопливных пиролизных котлах, служит источником энергии. В нефтеперерабатывающей промышленности из органических соединений углерода производят бензин и дизельное топливо. В значительной мере углерод необходим для производства сахара.
Также он применяется в синтезе органических соединений, важных для всех сфер повседневной жизни.
Источник: https://melscience.com/RU-ru/articles/uglerod/
№ 6 Углерод
Углерод известен с глубокой древности. В 1778 К. Шееле, нагревая графит с селитрой, обнаружил, что при этом,
как и при нагревании угля с селитрой, выделяется углекислый газ.
Химический состав алмаза был установлен в результате опытов А.Лавуазье
(1772) по изучения горения алмаза на воздухе и исследований С.
Теннанта
(1797), доказавшего, что одинаковые количества алмаза и угля дают при
окислении равные количества углекислого газа. Углерод как химический
элемент был признан только в 1789 А.Лавуазье. В начале XIX в. старое слово уголь в русской химической литературе иногда заменялось словом «углетвор» (Шерер, 1807; Севергин, 1815); с 1824 г. Соловьев ввел название углерод.
Латинское название сarboneum углерод получил от сarbo — уголь.
Получение:
Неполное сжигание метана : СН4 + О2 = С + 2Н2О (сажа);
Сухая перегонка древесины, каменного угля (древесный уголь, кокс).
Физические свойства:
Известны несколько кристаллических модификаций углерода: графит,алмаз, карбин, графен. Графит — серо-черная, непрозрачная, жирная на ощупь, чешуйчатая, очень мягкая масса с металлическим блеском. При
комнатной температуре и нормальном давлении (0,1 Мн/м2, или 1кгс/см2)
графит термодинамически стабилен.
При
атмосферном давлении и температуре около 3700°С графит возгоняется.
Жидкий углерод может быть получен при давлении выше 10,5 Мн/м2 (1051
кгс/см2) и температурах выше 3700°С. Cтруктура мелкокристаллического
графита лежит в основе строения «аморфного» углерода, который не представляет собой самостоятельной модификации (кокс, сажа, древесный уголь).
Нагревание некоторых разновидностей «аморфного» углерода выше
1500-1600°С без доступа воздуха вызывает их превращение в графит.
Физические свойства «аморфного» углерода очень сильно зависят от
дисперсности частиц и наличия примесей. Плотность, теплоемкость,
теплопроводность и электропроводность «аморфного» углерода всегда выше,
чем графита.
Алмаз — очень твердое, кристаллическое
вещество. Кристаллы имеют кубическую гранецентрированную решетку:
а=3,560. При комнатной температуре и нормальном давлении алмаз
метастабилен. Заметное превращение алмаза в графит наблюдается при
температурах выше 1400°С в вакууме или в инертной атмосфере. Карбин получен искусственно.
Он представляет собой
мелкокристаллический порошок черного цвета (плотность 1,9 — 2 г/см3).
Построен из длинных цепочек атомов С, уложенных параллельно друг другу.
Графен — мономолекулярный слой (слой, толщиной в одну молекулу) атомов углерода, которые плотно упакованы в двухмерную решетку, по форме напоминающую пчелиные соты.
Графен был впервые получен и исследован Александром Геймом и Константином Новоселовым, которые стали за это открытие лауреатами Нобелевской премии по физике 2010 года.
Химические свойства:
- Углерод малоактивен, на холоду реагирует только с F2 (образуя CF4). При нагревании реагирует со многими неметаллами и сложными веществами, проявляя восстановительные свойства:
CO2 + C = CO выше 900°С
2H2O + C = CO2 + H2 выше 1000°С или H2O + C = CO + H2 выше 1200°С
CuO + C = Cu + CO - HNO3 + 3C = 3 CO2 + 4 NO + 2 H2O
- Ca + С = CaС2 карбид кальция
- CaO + C = CaC2 + CO
Слабые окислительные свойства проявляются в реакциях с металлами, водородом
Si + С = CSi карборунд
Важнейшие соединения:
Оксиды СО, СО2
Угольная кислота Н2СО3, карбонаты кальция (мел, мрамор, кальцит, известняк),
Карбиды СаС2
Органические вещества, например углеводороды, белки, жиры
Применение:
Графит используется в карандашной промышленности, также исполузется как смазка при особо высоких или низких температурах. Алмаз используется в качестве абразивного материала, драгоценных камней в ювелирных украшениях .
Алмазным напылением обладают шлифовальные насадки бормашин. В фармакологии и медицине используются соединения углерода — производные угольной кислоты и карбоновых кислот, различные гетероциклы, полимеры и др.
Так, карболен (активированный уголь), применяется для абсорбции и выведения из организма различных токсинов; графит (в виде мазей) — для лечения кожных заболеваний; радиоактивные изотопы углерода — для научных исследований (радиоуглеродный анализ).
Углерод в виде ископаемого топлива: угля и углеводородов (нефть, природный газ) — один из важнейших источников энергии для человечества.
Карпенко Д.
ХФ ТюмГУ 561гр.
Источник: http://www.kontren.narod.ru/x_el/info06.htm


 планете была бы невозможна. Теперь поговорим об углероде — элементе, который является основой жизни на земле. Ученые, уфологи и фантасты даже ввели в обиход термин «углеродная жизнь». И он вполне справедлив, так как все белки, аминокислоты, жиры, ДНК и РНК построены на основе углеводородных молекул.Углерод — простое неорганическое вещество, элемент таблицы Менделеева. Обозначается буквой «С» (Carboneum). В виде алмазов, графита и древесного угля известен человечеству с древнейших времен. Название carbone (углерод) впервые было введено в химическую науку французскими учеными. А. Лавуазье доказал, что уголь — это элементарное химическое вещество, а не носитель некоего невесомого флюида флогистона, отвечающего за горючие свойства веществ. Он же установил, что алмаз — это кристаллическая форма углерода.
планете была бы невозможна. Теперь поговорим об углероде — элементе, который является основой жизни на земле. Ученые, уфологи и фантасты даже ввели в обиход термин «углеродная жизнь». И он вполне справедлив, так как все белки, аминокислоты, жиры, ДНК и РНК построены на основе углеводородных молекул.Углерод — простое неорганическое вещество, элемент таблицы Менделеева. Обозначается буквой «С» (Carboneum). В виде алмазов, графита и древесного угля известен человечеству с древнейших времен. Название carbone (углерод) впервые было введено в химическую науку французскими учеными. А. Лавуазье доказал, что уголь — это элементарное химическое вещество, а не носитель некоего невесомого флюида флогистона, отвечающего за горючие свойства веществ. Он же установил, что алмаз — это кристаллическая форма углерода.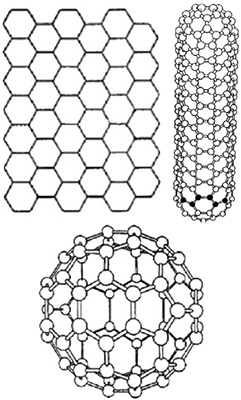 реагируют с водородом, азотом, фтором, галогенами, щелочными металлами, солями металлов, серой. В результате реакции с водородом и азотом получается синильная кислота. Взаимодействие большинства металлов, углерода, бора и кремния приводит к образованию карбидов. Углерод восстанавливает оксиды металлов до металлов. При определенных условиях удается преобразовать углерод, содержащийся в твердых видах топлива, в горючие газы (реакция газификации топлив очень важна для промышленности).
реагируют с водородом, азотом, фтором, галогенами, щелочными металлами, солями металлов, серой. В результате реакции с водородом и азотом получается синильная кислота. Взаимодействие большинства металлов, углерода, бора и кремния приводит к образованию карбидов. Углерод восстанавливает оксиды металлов до металлов. При определенных условиях удается преобразовать углерод, содержащийся в твердых видах топлива, в горючие газы (реакция газификации топлив очень важна для промышленности).